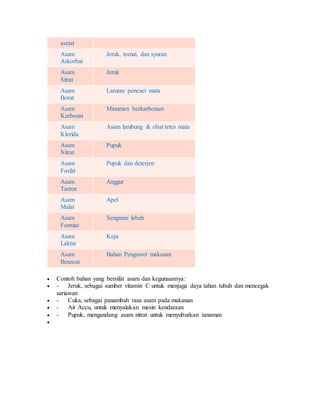
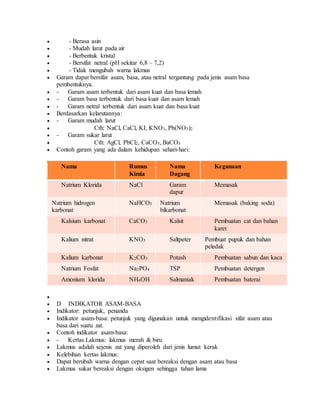
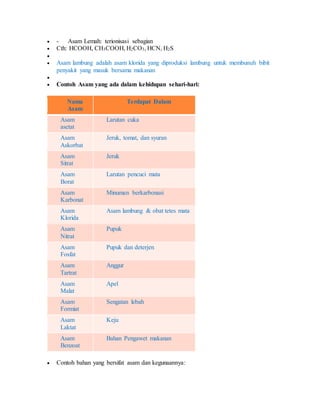
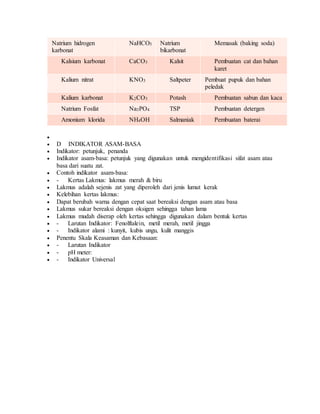
Dokumen ini menjelaskan pengertian, sifat, dan contoh dari senyawa asam, basa, dan garam dalam kimia. Asam menghasilkan ion H+ dalam air dan memiliki pH kurang dari 7, sementara basa menghasilkan ion OH- dan memiliki pH lebih dari 7; garam adalah hasil reaksi antara asam dan basa. Selain itu, dokumen ini juga mencakup cara mengidentifikasi asam, basa, dan garam menggunakan indikator seperti kertas lakmus.