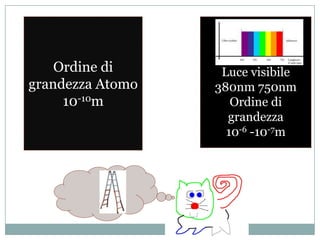
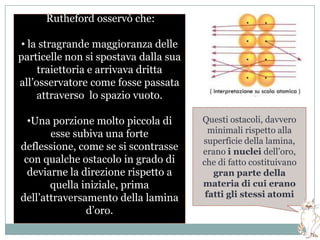
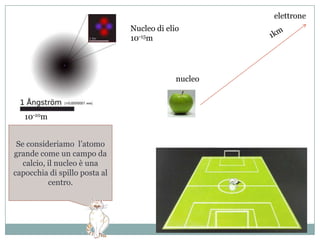
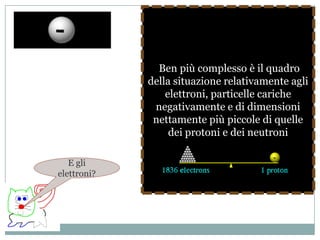
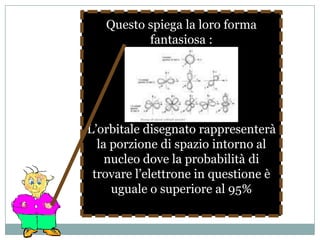
Il documento esplora la struttura e la natura degli atomi, enfatizzando che gli atomi sono principalmente vuoti e composti da un nucleo centrale con protoni e neutroni, circondato da elettroni disposti in orbitali. Si discute la difficoltà di isolare atomi singoli, evidenziando come tendano a unirsi per stabilità e come la chimica riguardi principalmente le interazioni tra masse di atomi piuttosto che atomi isolati. Infine, viene menzionato che le scoperte chimiche precedenti al XX secolo sono avvenute senza una comprensione dettagliata della struttura atomica.