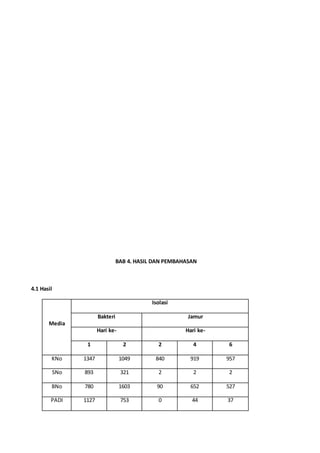
Dokumen ini menjelaskan tata cara isolasi bakteri untuk mendapatkan biakan murni melalui berbagai metode seperti pengenceran, penggoresan, dan inokulasi hewan. Metode streak plate digunakan dalam praktik untuk memisahkan koloni bakteri, sedangkan keberhasilan isolasi bergantung pada teknik yang tepat dan menjaga kesterilan lingkungan. Isolasi bakteri penting untuk memahami morfologi dan sifat biokimia mikroba dalam ekosistem.