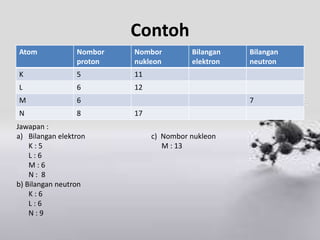
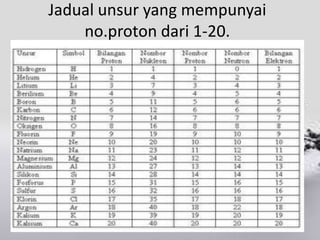
Dokumen ini menerangkan konsep atom, termasuk nombor atom, nombor nukleon, dan susunan elektron dalam petala atom. Ia juga membincangkan isotop dan memberikan contoh penggunaan isotop dalam pelbagai aplikasi, seperti dalam perubatan dan pengujian. Beberapa soalan akhir ditujukan untuk menguji pemahaman konsep yang dijelaskan.