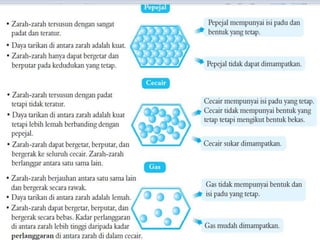
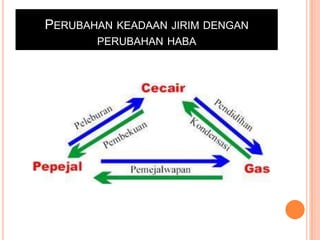
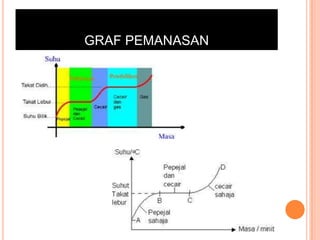
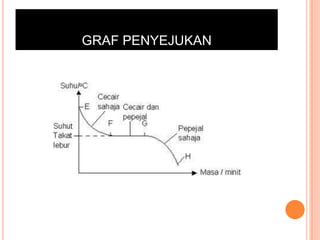
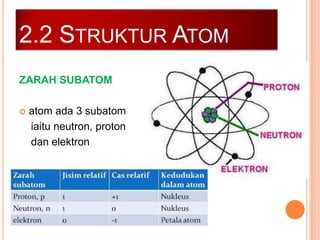
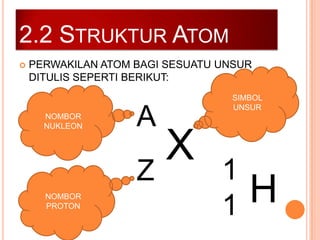
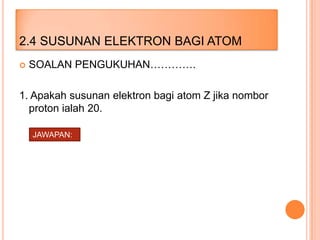
Bab ini membincangkan struktur atom dan jirim, termasuk jenis-jenis jirim seperti atom, molekul, dan ion. Ia menerangkan model-model atom yang telah dikemukakan oleh saintis seperti Dalton, Thomson, Rutherford, Bohr, dan Chadwick. Selain itu, tajuk menyentuh tentang isotop, kepentingannya dalam kehidupan, serta susunan elektron dalam atom.