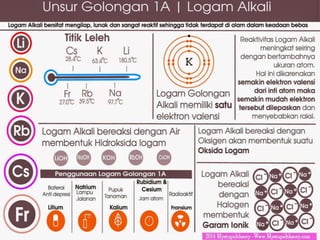
Dokumen tersebut membahas tentang unsur-unsur kimia golongan alkali, mulai dari litium, natrium, kalium, rubidium hingga cesium. Unsur-unsur tersebut memiliki sifat yang mirip seperti sangat reaktif terhadap udara dan air, lunak, berwarna perak, dan dapat diisolasi melalui proses elektrolisis atau reduksi.