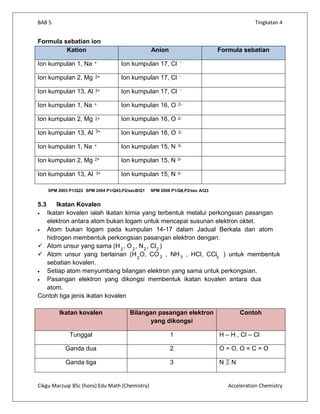
Dokumen ini menerangkan tentang ikatan kimia, pembentukan sebatian, dan jenis-jenis ikatan seperti ikatan ion dan kovalen. Sebatian terbentuk melalui gabungan unsur, manakala ikatan ion melibatkan pemindahan elektron, dan ikatan kovalen melalui perkongsian elektron. Sifat sebatian dipengaruhi oleh jenis ikatan yang membentuknya, dengan sebatian ion biasanya pepejal dengan takat lebur dan didih yang tinggi, sementara sebatian kovalen sering wujud dalam bentuk cecair atau gas dengan takat lebur dan didih yang rendah.