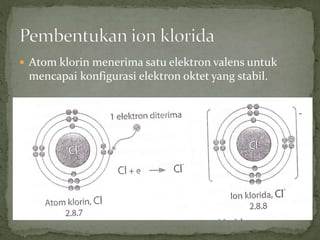
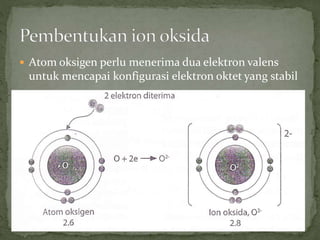
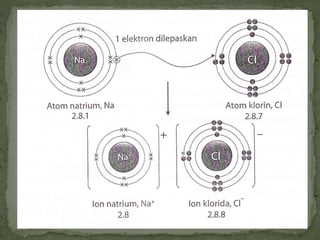
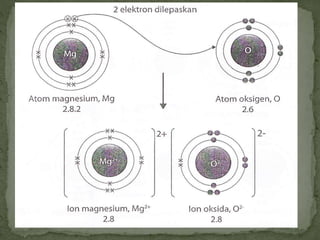
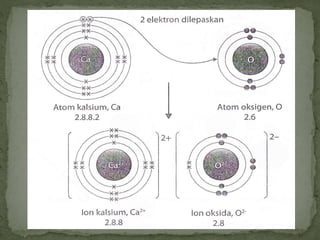
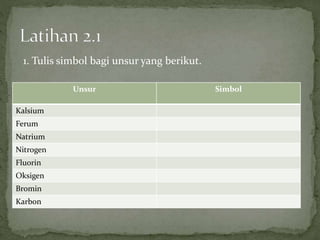
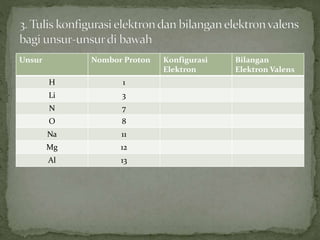
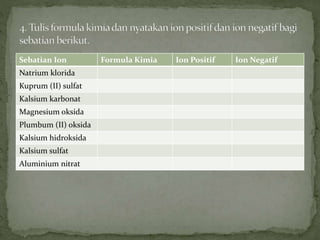
Dokumen ini mengandungi maklumat tentang tindak balas kimia dan pembentukan sebatian ion, termasuk jenis ikatan kimia seperti ion dan kovalen serta contoh-contohnya. Ia juga menerangkan mengenai pemindahan elektron valens untuk membentuk ion positif (kation) dan ion negatif (anion) dari unsur logam dan bukan logam, serta cara mencapai konfigurasi elektron yang stabil. Pembentukan formula kimia bagi sebatian ion juga dibincangkan, termasuk model dan latihan berkaitan.