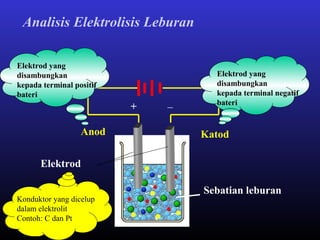
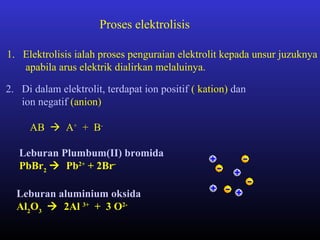
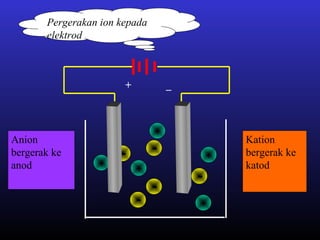
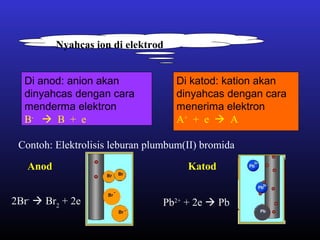
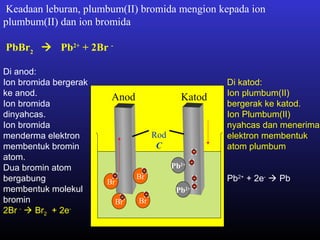
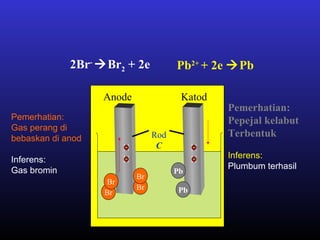
Elektrolisis leburan plumbum(II) bromida menghasilkan plumbum cecair di katod dan bromin gas di anod melalui proses penguraian ion plumbum dan bromida serta penghantaran elektron. Arus elektrik menyebabkan ion-ion bergerak ke elektrod yang sesuai di mana ion-ion tersebut akan dinyahcas.