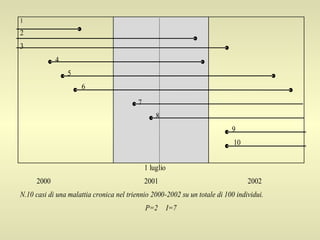
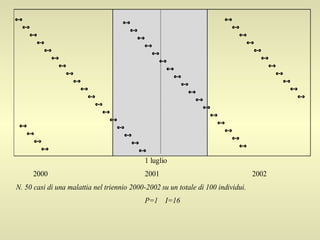
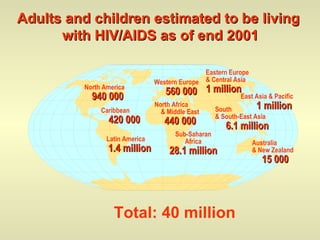
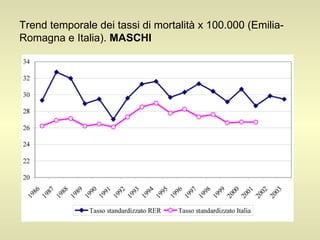
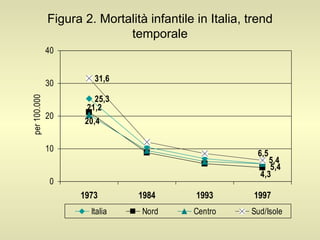
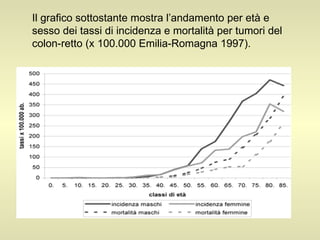
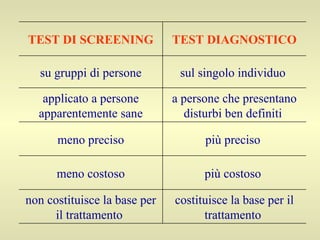
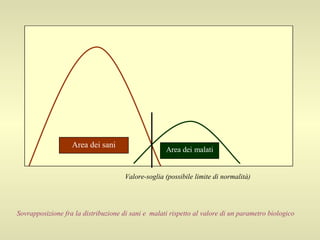
L'epidemiologia studia la distribuzione di salute e malattia nelle popolazioni, cercando di identificare le cause e prevenire le malattie attraverso diverse metodologie, come epidemiologia descrittiva, analitica e sperimentale. Essa analizza i tassi di morbosità, mortalità e natalità per valutare l'impatto delle malattie e dei fattori di rischio. Le tecniche includono studi caso-controllo, di coorte e trasversali per individuare relazioni causa-effetto tra esposizione e malattia.