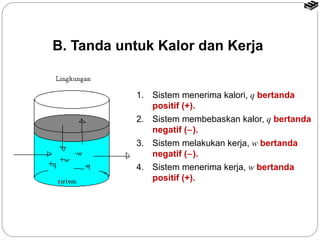
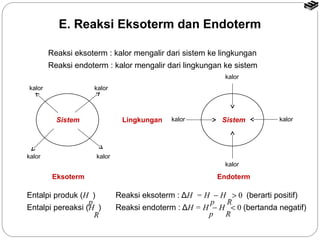
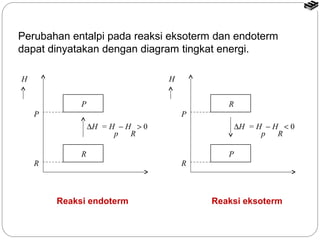
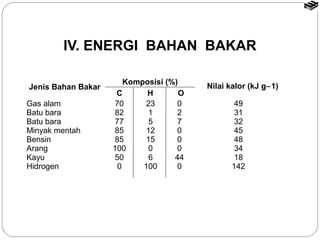
Dokumen tersebut membahas tentang termodinamika kimia yang mencakup konsep dasar seperti sistem dan lingkungan, tanda kalor dan kerja, entalpi reaksi, reaksi eksoterm dan endoterm, serta cara menentukan nilai entalpi reaksi melalui kalorimetri, hukum Hess, tabel entalpi pembentukan, dan energi ikatan.