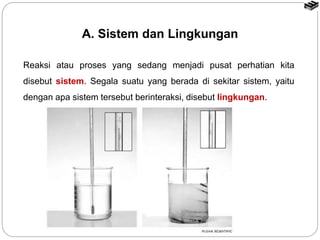
Dokumen ini membahas termokimia, termasuk perubahan energi dalam reaksi kimia, sistem energi, dan hukum pertama termodinamika. Selain itu, dijelaskan perbedaan antara reaksi eksoterm dan endoterm serta cara pengukuran perubahan entalpi melalui kalorimetri dan hukum Hess. Contoh persamaan termokimia menyoroti pentingnya entalpi dalam reaksi kimia dan menentukan kondisi standar untuk pengukuran.