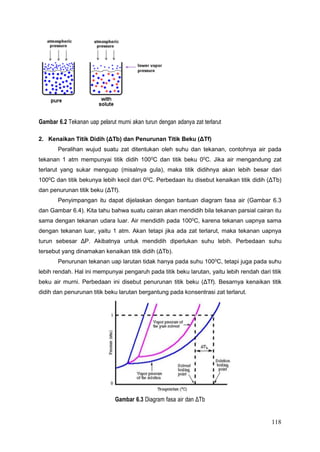
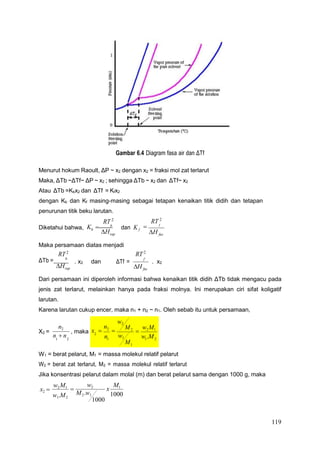
Dokumen tersebut membahas tentang larutan dan konsentrasinya. Ia menjelaskan komponen larutan, proses pembentukannya, dan berbagai macam konsentrasi seperti persen berat, fraksi mol, molaritas, molalitas dan normalitas. Dokumen tersebut juga menjelaskan sifat koligatif larutan dan contoh soal perhitungan konsentrasi.













![126
4 3
3 2
a. Identifikasikan asam dan basa Bronsted Lowry dan konjugatnya pada masing-masing
persamaan ionisasi berikut.
HS-
+ H2O H2S + OH-
HNO3 + H2PO -
H3PO4 + NO -
b. Identifkasikan asam dan basa Lewis pada persamaan berikut.
Ag+
+ 2NH3 Ag(NH ) +
Li+
+ CH3OH Li(CH3OH)+
F. Kesetimbangan Air (Kw) dan Konsep pH
Air murni dapat menghantarkan arus listrik bila dideteksi dengan alat ukur yang
cukup sensitif. Hantaran arus listrik disebabkan oleh adanya ion-ion, namun dari mana ion-
ion tersebut dalam air murni? Teori Bronsted-Lowry dapat membantu kita untuk
mendeskripsikan bagaimana ion-ion tersebut dibentuk. Ingat bahwa air merupakan
amfiprotik. Sehingga molekul-molekul air dapat saling memberi dan menerima proton.
Dalam reaksi autoionisasi air, setiap molekul H2O menyumbangkan sebuah proton, dan
molekul H2O yang lain menerimanya. Ion-ion hidronium dan hidroksida terbentuk dalam
jumlah yang sama. Karena H3O+ dan OH- masing-masing berperan sebagai asam dan basa
yang lebih kuat dari molekul H2O, sehinggga kesetimbangan bergeser jauh ke arah kiri,
seperti yang ditunjukkan dalam persamaan berikut.
H2O + H2O H3O+
+ OH-
Asam(1) basa(2) asam(2) basa(1)
Sehingga, Kc =
[H ][OH ]
[H2O]
Derajat ionisasi () air sangat kecil, maka jumlah air yang terion dapat dibaikan, sehingga
konsentrasi air yang tidak terion dapat dianggap konstan.
Kc [H2O]2
= [H3O+
][OH-
] atau Kw = [H3O+
][OH-
]
Kw disebut tetapan hasil kali ion atau tetapan air, yaitu hasil kali konsentrasi molar pada
temperatur tertentu.
Berdasarkan eksperimen telah ditentukan bahwa konsentrasi kesetimbangan pada
250
C dalam air murni adalah [H3O+
] = [OH-
] = 1,0 x 10-7
M, sehingga:
Kw = [H3O+
][OH-
] = (1,0 x 10-7
)(1,0 x 10-7
) = 1,0 x 10-14
Tetapan hasil kali ion untuk air ini sering diterapkan pada semua larutan berair (aq) yaitu
larutan asam, basa, garam atau non elektrolit.
Sebagai contoh, larutan asam kuat HCl 0,00015 M yang terionisasi secara
sempurna: HCl + H2O H3O+
+ Cl-](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-16-320.jpg)
![127
3
Jumlah [H3O+
] yang dihasilkan HCl lebih besar dari yang ada dalam air murni, sehingga kita
dapat nyatakan bahwa dalam larutan terdapat [H3O+
] = 0,00015 M = 1,5 x 10-4
M. Dengan
menggunakan persamaan Kw kita dapat menghitung [OH-
] dalam larutan.
K 1,0x1014
[OH-
] =
w
= 6,7 x 10-11
M
[H O ] 1,5x104
G. pH dan pOH
Notasi eksponensial merupakan suatu cara untuk menunjukkan suatu bentuk
eksponen, seperti 1,5 x 10-4
. pada tahun 1909 seorang ahli biokimia dari Denmark Soren
Sorensen mengemukakan sebuah pernyataan yang masih digunakan sampai sekarang.
Beliau menggunakan lambang pH sebagai “potensial ion hidrogen” dan didefinisikan
sebagai negatif logaritma dari [H+
] atau [H3O+
].
atau
Di dalam larutan HCl 0,00015 M, terdapat [H3O+
] = 1,5 x 10-4
M, maka:
pH = - log [H3O+
] = - log (1,5 x 10-4
) = - ( -3,82) = 3,82.
Untuk menentukan [H3O+
] dari suatu nilai pH yang telah diketahui diperlukan
antilogaritma. Sebagai contoh, dalam larutan dengan pH = 2,19
- log [H3O+
] = pH - log [H3O+
] = 2,19 log [H3O+
] = -2,19
[H3O+] = anti log ( -2,19) = 10-2,19 = 6,5 x 10-3
Bila suatu larutan NaOH 2,5 x 10-3 M mempunyai [OH-] = 2,5 x 10-3 M maka:
pOH = - log (2,5 x 10-3
) = - ( -2,60) = 2,60
Analog dengan pH dan pOH, maka pKw merupakan logaritma negatif dari Kw.
pKw = - log Kw = - log (1,0 x 10-14
) = - ( -14,00) = 14,00
Untuk mendapatkan hubungan yang sederhana antara pH dan pOH dari larutan, maka:
Kw = [H3O+
][OH-
] = 1,0 x 10-14
- log Kw= - log [H3O+
][OH-
] = - log 1,0 x 10-14
pKw = - log [H3O+] - log [OH-] = 14,00 pKw = pH + pOH = 14,00
Sehingga pH dari 2,5 x 10-3
M NaOH adalah: 14,00 – 2,60 = 11,40
Gambar 6.8 Harga pH asam dan basa
pOH = log [OH-]
pH = log [H3O+]](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-17-320.jpg)
![128
Dalam air murni, dimana [H3O+
] = [OH-
] = 1,0 x 10-7 M, maka nilai pH dan pOH
keduanya adalah 7,00. Air murni dan semua larutan dengan pH = 7,00 adalah netral. Bila
pH kurang dari 7,00 maka larutan bersifat asam; bila pH di atas 7,00, larutan bersifat basa
atau alkalin. Larutan bersifat lebih asam, bila [H3O+
] meningkat dan pH menurun. Larutan
bersifat lebih basa, bila [H3O+] menurun dan pHnya meningkat.
Gambar 6.9 memberikan nilai pH dari sejumlah bahan yang telah umum dikenal.
Anda boleh menggunakannya sebagai pedoman. Karena pH merupakan suatu skala
logaritma, maka perubahan setiap unit dalam pH berarti perubahan 1/10 dari jumlah [H3O+]
yang ada.
Gambar 6.9 Harga pH dari sejumlah bahan
Umum dengan rentang nilai 0-14
H. Kesetimbangan Larutan Asam lemah dan Basa lemah
Biasanya cuka dalam larutan mengandung asam asetat sebagai zat terlarut yang
utama; dan memberikan aroma asam. CH3COOH adalah asam lemah, sedangkan HCl
asam kuat. Dalam larutan HCl, perubahan menjadi H3O+
sangat sempurna, tetapi reaksi
dalam larutan asam asetat tidak berjalan secara sempurna. Untuk larutan dengan molaritas
zat terlarut yang sama, hanya ada sedikit H3O+
dalam CH3COOH (aq) dibandingkan dengan
yang ada dalam HCl (aq). Dan ingat, makin rendah [H3O+
] berarti makin tinggi pH.](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-18-320.jpg)
![129
[H3O+] = K a C a
pH = ½ pKa - ½ log Ca
[OH-] = K bC b
pOH = ½ pKb - ½ log Cb
Gambar 6.10 Bukti bahwa asam karbonat
merupakan asam lemah
Untuk menghitung nilai pH larutan asam/basa lemah diperlukan tetapan ionisasi
secara tepat, yaitu Ka dan Kb. Anda akan temukan tetapan ionisasi ini dalam Tabel 3.
Dalam setiap perhitungan, kita juga akan menggunakan rumus pKa = - log Ka; pKb
= - log Kb. Makin kecil nilai pKa dan pKb berarti makin besar nilai Ka dan Kb, makin rendah
nilai pH berarti makin tinggi [H3O+
]. Berdasarkan Tabel 6.3 di dapat, makin meningkat nilai
pKa dan pKb maka kekuatan asam dan basa makin menurun.
Untuk asam lemah, jika [H3O+] lebih kecil dari 0,05 Ca, gunakan rumus berikut:
Untuk basa lemah:
TABEL 6.3 Tetapan beberapa Asam dan Basa Lemah dalam Air pada 250
C
Kesetimbangan Ionisasi Tetapan Ionisasi pK
Asam Anorganik
HClO2 + H2O H3O+
+ ClO2
HNO2 + H2O H3O+
+ NO -
2
HF + H2O H3O+
+ F-
HOCl + H2O H3O+
+ Ocl-
HOBr + H2O H3O+
+ Obr-
HCN + H2O H3O+
+ CN-
CH2ClCOOH + H2O H3O+
+ CH2ClCOO-
HCOOH + H2O H3O+
+ HCOO-
C6H5COOH + H2O H3O+
+ C6H5COO-
CH3COOH + H2O H3O+
+ CH3COO-
NH3 + H2O NH + + OH-
4
H2NNH2 + H2O H2NNH2 + OH-
Ka=
Asam Klorat 1,1 x 10-2
1,96
Asam Nitrit 7,2 x 10-4
3,14
Asam Fluorida 6,6 x 10-4
3,18
Asam Hipoklorit 2,9 x 10-8 7,54
Asam Hipobromit 2,5 x 10-9
8,60
Asam Sianida 6,2 x 10-10
9,21
Asam Karboksilat Ka=
Asam Kloroasetat 1,4 x 10-3
2,85
Asam Format 1,8 x 10-4
3,74
Asam Benzoat 6,3 x 10-5
4,20
Asam Asetat 1,8 x 10-5
4,74
Basa Anorganik Kb=
Ammonia 1,8 x 10-5
4,74
Hidrazin 8,5 x 10-7
6,07](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-19-320.jpg)
![130
︵
︶
2
H
O
-
H
O
l
o
m
2
g
M
l
o
m
1
x
-
H
O
l
o
m
4
-
0
1
x
3
,
3
L
1
3
Amina
(CH3)2NH + H2O (CH3)2NH +
+ OH-
2
CH3CH2NH2 + H2O CH3CH2NH3 +
+
OH-
CH3NH2 + H2O CH3NH + + OH-
3
HONH2 + H2O HONH +
+ OH-
3
C3H5N + H2O C3H5NH+
+ OH-
C6H5NH2 + H2O C6H5NH +
+ OH-
3
Kb=
Dietilamina 5,9 x 10-4
3,23
Etilamina 4,3 x 10-4
3,37
Metilamina 4,2 x 10-4
3,38
Hidroksiamina 9,1 x 10-9
8,04
Piridin 1,5 x 10-9
8,82
Anilin 7,4 x 10-10
9,13
Contoh:
a. Seorang siswa menentukan pH “larutan magnesia” – suatu suspensi magnesium
hidroksida padatan dalam larutan jenuh, diperoleh nilai pH 10,52. Berapa molaritas
Mg(OH)2 dalam larutan jenuh tersebut ? Mg(OH)2(s) yang tidak larut tidak berpengaruh
pada perhitungan.
b. Hitung pH larutan CH3COOH(aq) 0,1 M. (Ka = 1,8 x 10-5)
c. Berapakah pH dari larutan NH3(aq) 0,1 M ? (Kb = 1,8 x 10-5
)
Penyelesaian:
a. Asumsikan bahwa magnesium hidroksida yang larut mengalami disosiasi secara
sempurna.
Reaksi: Mg(OH)2(aq) Mg2+
(aq) + 2OH-
(aq); maka:
pOH = 14 – pH pOH = 14 – 10,52 = 3,48
log [OH-
] = - 3,48 [OH-] = 10-3,48
= 3,3 x 10-4
M
Dari perhitungan tersebut kita dapatkan
Molaritas =
b.
H O
= 1,7 x 10-4
mol Mg(OH)2/L = 1,7 x 10-4
M Mg(OH)2
= 4,24 x 10-3
M
pH = - log 4,24 x 10-3
= 2,87
c. OH = 4,24 x 10-3
M
pOH = - log 4,24 x 10-3
= 2,87
pH = 14 – 2,87 = 11,13
Latihan 6:
a. Berapakah pH larutan yang dibuat dari 0,0155 mol Ba(OH)2 dalam 735 mL air ?
Asumsikan bahwa Ba(OH)2 mengalami disosiasi secara sempurna.
b. Tentukan pH C6H5COOH (asam benzoat) 0,25 M. Lihat nilai Ka dari Tabel 3.
c. Berapakah pH dari NH3(aq) 0,001 M. Lihat nilai Ka dari Tabel 3.
1,8x105
x101
1,8x105
x101](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-20-320.jpg)


![133
4
O
P
3
H
4
O
P
3
H
l
o
g
8
m
1
9
x
4
O
P
g
0
0
1
3
H
g
5
4
a
Ka x Kb = Kw
CH3COO-
+ H2O CH3COOH + OH-
Kb = ?
CH3COOH
OH
Kb
CH OOH
= ?
3
Dua konsentrasi dalam Kb sama dengan Ka untuk ionisasi asam asetat, asam
konjugat dari CH3COO-. Kemudian Kb untuk CH3COO- dan Ka untuk CH3COOH akan
dihubungkan satu sama lain. Bila kita mengalikan kedua pembilang dan penyebut Kb
dengan [H3O+
], maka
CH3COOH
OH
H3O
K 1,0x1014
Kb w
= 5,6 x 10-10
5
CH3OOH
H3O
K 1,8x10
Ingat bahwa [OH-
][H3O+
] ekivalen dengan Kw.
CH3COO
H3O
CH3OOH
menunjukkan kebalikan Ka untuk asam asetat, 1/Ka.
Cara umum untuk menuliskan persamaan di atas adalah sebagai berikut.
Contoh
a. Suatu industri menggunakan asam fosfat untuk menghilangkan deposit dari ketel uap
pabriknya. Larutan yang digunakan adalah H3PO4 5% berat (d = 1,03 g/ml). Berapakah
pH dari larutan dalam pembersih ketel uap tersebut ?
b. Prediksikan apakah larutan-larutan berikut bersifat asam, basa atau netral: (a) NH4I(aq),
(b) CH3COONH4(aq)
c. Hitung pH larutan natrium asetat, CH3COONa(aq) 0,25 M.
Penyelesaian
a. Ingat bahwa semua H3O+
berasal dari ionisasi tahap pertama:
H3PO4 + H2O H3O+
+ H2PO -
Massa 1,00 L sampel larutan adalah
Massa = 1,00 L x
1000L
1L
=
1,03g
mL
= 1030 g
Jumlah mol H3PO4 dalam 1,00 L larutan adalah
? mol H3PO4 = 1030 g x = 0,5 molH3PO4
Jadi asam dalam pembersih ketel uap adalah H3PO4 0,5 M.](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-23-320.jpg)
![134
4
4
4 2 3 3
4 2 3 3 3 2 3
a
H3PO4 + H2O H3O+
+ H2PO -
Konsentrasi mula, M: 0,5 - -
Perubahan,M: -x +x +x
Kons. Kesetimbangan, M: (0,5-x) x x
H O
H PO
Ka1
H3PO4
= 7,1 x 10-3
Jika dianggap bahwa x << 0,5, maka (0,5-x) = 0,5, maka dapat ditulis
x2
= 0,5 x 7,1 x 10-3
= 4 x 10-3
x = [H3O+
] = 0,06 M
pH = - log [H3O+
] = - log (0,06) = 1,2
Asumsi kita ternyata tidak dapat digunakan, karena x lebih besar dari 5% dari [H3PO4]. x
= 0,06 adalah 12% dari 0,5.
b. NH4I adalah garam yang berasal dari asam kuat, HI, dan basa lemah, NH3. Kation, NH +,
mengalami hidrolisis, dan menghasilkan larutan yang bersifat asam.
NH +
+ H O NH + H O+
Anion I-, merupakan basa yang sangat lemah, sehingga tidak dapat terhidrolisis.
Ammonium asetat adalah garam yang berasal dari asam lemah, CH3COOH, dan basa
lemah, NH3. Seperti yang ditunjukkan oleh poin 4 di atas; kedua ion mengalami hidolisis:
NH +
+ H O NH + H O+
dan CH COO-
+ H O CH COOH + OH-
c. Dalam larutan CH3COONa(aq), ion asetat terionisasi sebagai basa, dan mempunyai nilai
Kb. Persamaan reaksi hidrolisis ditunjukkan sebagai berikut.
CH3COOH
OH
H3O
K 1,0x1014
Kb w
= 5,6 x 10-10
5
CH3OOH
H3O
K 1,8x10
Kita asumsikan bahwa x << 0,25, maka (0,25 – x) = 0,25
x2
= 5,6 x 10-10
x2
= 1,4 x 10-10
0,25 x = [OH-
] = (1,4 x 10-10
)½
= 1,2 x 10-5
pOH = - log [OH-
] = - log (1,2 x 10-5
) = 4,92
pH = 14,00 – pOH = 14,00 – 4,92 = 9,08
Atau dengan cara praktis :
pH = ½ pKw + ½ pKa + ½ log Cg = 7+ 2,37 – 0,3 = 9,07
3 2 4
CH3COO- + H2O CH3COOH + OH-
Konsentrasi awal, M: 0,25 - -
Perubahan,M: -x +x +x
Kons. Kesetimbangan, M: (0,25-x) x x](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-24-320.jpg)
![135
4 4
H A
Bila suatu garam menghasilkan CH3COO-,
kesetimbangan akan bergeser kearah kiri
Latihan 7
a. Berapa konsentrasi ion dihidrogen fosfat H2PO -, dan ion hidrogen fosfat HPO 2-, dalam
pembersih ketel pada contoh diatas?
b. Prediksikan apakah larutan-larutan berikut bersifat asam, basa atau netral: (a)
NaNO3(aq), (b) CH3CH2COOK(aq).
c. Hitung pH larutan NH4Cl 0,052 M.
J. Pengaruh Ion Senama
Perhatikan garam CH3COONa, yang terbentuk dari basa kuat dan asam lemah, bila
dalam larutan terdapat campuran asam asetat, CH3COOH, dan natrium asetat, CH3COON,
maka keduanya menghasilkan ion asetat, CH3COO-
.
CH3COOH (aq) + H2O H3O+
+ CH3COO-
CH3COONa (s) H
2O
Na+
+ CH3COO-
Asam asetat adalah asam lemah yang hanya sedikit terurai menjadi ion, dan dalam
larutan terdapat kesetimbangan. Sedangkan garam CH3COONa adalah elektrolit kuat,
terurai sempurna menjadi Na+
dan CH3COO-
. Dalam penambahan ion CH3COO-
dalam
larutan yang berasal dari CH3COONa maka, sesuai dengan azas Le Chatelier reaksi
kesetimbangan CH3COOH akan bergeser ke kiri.
CH3COOH + H2O H3O+
+ CH3COOH
Asam(1) basa(2) asam(2) basa(1)
CH3COO-
adalah suatu basa yang dikonsumsi dalam reaksi balik, maka H3O+
adalah
asam. Karena [H3O+
] berkurang maka pH larutan akan meningkat. Dalam larutan asam
asetat dan larutan natrium asetat, ion asetat adalah ion senama yang mempengaruhi
pergeseran kesetimbangan.
Perhatikan suatu larutan yang merupakan campuran dari asam lemah HA dan
garamnya BA.
BA B+
+ A-
; HA H+
+ A-
Tetapan ionisasi Ka:
Ka =
dan [H+
] = Ka
HA
HA
A
Oleh karena [HA] hanya sedikit mengion, sedangkan BA terurai sempurna maka [HA]
dianggap sebagai konsentrasi asam dan [A-] sebagai konsentrasi garam. Maka:](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-25-320.jpg)

![137
4
4
4 2 3
4
Penyelesaian
a. CH3COONa(s) H
2O
Na+
(aq) + CH3COO-
(aq)
CH3COO
pH = pKa + log
CH OOH
pKa = - log Ka = - log (1,8 x 10-5
) = 4,74
pH = 4,74 + log
0,15
0,10
= 4,92
b. Persamaan yang relevan adalah sebagai berikut: NH3 + H2O NH +
+ OH-
[OH-
] = Kb x
NH3
NH
[OH-
] = 1,8 x 10-5
x
0,24
0,20
= 2,2 x 10-5
pOH = - log [OH-] = - log (2,2 x 10-5) = 4,66
pH = 14,00 – pOH = 14,00 – 4,66 = 9,34
Pertama, hitung penetralan akibat penambahan NaOH. Penambahan 0,005 mol OH- ke
dalam buffer 0,500 L menghasilkan [OH-
] = 0,005 mol OH/0,500 L = 0,010 M. [OH-
] ini
berkurang sampai mendekati nol dengan penetralan.
NH +
+ OH-
H O + NH
Buffer awal, M: 0,20M 0,24M
Penambahan: 0,01M
Perubahan: -0,01M -0,01M +0,01M
Setelah Penetralan: 0,19M ≈0 M 0,25M
Sekarang kita terapkan persamaan berikut.
NH3
0,25
[OH-] = Kb x
NH
= 1,8 x 10-5 x
0,19
= 2,4 x 10-5
pOH = - log [OH-
] = - log (2,4 x 10-5
) = 4,62
pH = 14,00 – pOH = 14,00 – 4,62 = 9,38
Sebagai alternatif, kita dapat menerapkan persamaan Handerson-Haselbalch:
Dalam hal ini, asam adalah NH4
+
dan garam adalah NH3. Ingat kembali bahwa pKa + pKb
= 14,00, dan kita punya
pKa = 14,00 – pKb = 14,00 – [- log (1,8 x 10-5
)]
= 14,00 – 4,74 = 9,26
pH = 9,26 + log
0,25
pH = 9,26 + 0,12 = 9,38
0,19
3](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-27-320.jpg)
![138
4
4
4
Latihan 8
a. Hitung pH larutan yang mengandung NH3 0,15 M dan NH4NO3 0,35 M.
NH3 + H2O NH +
+ OH-
Kb = 1,8 x 10-5
b. Hitung pH suatu larutan buffer yang dibuat dengan cara mencampurkan 100 mL NaOH
0,20 M dan 150 mL CH3COOH 0,40 M. (Ka = 1,8 x 10-5
)
L. Hasil Kali Kelarutan
Kelarutan suatu zat adalah jumlah zat yang melarut dalam satu liter larutan jenuh
pada suhu tertentu. “Jumlah” zat dapat dinyatakan dalam mol atau gram. Kelarutan molar
suatu zat (S) adalah jumlah mol zat yang melarut dalam satu liter larutan jenuh pada suhu
tertentu. Sedangkan hasil kali kelarutan suatu garam adalah hasil kali konsentrasi semua ion
dalm larutan jenuh pada suhu tertentu dan masing-masing ion diberi pangkat dengan
koefisien dalam rumus tersebut.
AgCl Ksp = [Ag+
][Cl-
] = 1,78 x 10-10
Ag2CrO4 Ksp = [Ag+][CrO 2-] = 1,3 x 10-12
CaK2(SO4)26H20 Ksp = [Ca2+
][K+
][SO 2-
]2
= 1 x 10-9
Kelarutan Ksp, pKsp
Ksp suatu garam adalah ukuran kelarutan garam tersebut. Bila diketahui kelarutan
molar, maka Ksp dapat dihitung. Sebaliknya bila diketahui Ksp maka dapat dihitung
kelarutan molar. Selain Ksp sering digunakan pKsp (- log Ksp). Secara aljabar, semakin
kecil Ksp semakin besar pKsp. Harga pKsp yang besar (positif) menunjukkan kelrutan yang
kecil, pKsp yang kecil (negatif) menunjukkan kelarutan besar.
M. Indikator pH
Suatu indikator yang umumnya digunakan untuk menguji pH air kolam renang.
Dengan menambahkan sedikit tetesan fenol merah ke dalam sejumlah kecil air suling,
warna air kelihatan sedikit jingga. Sekarang, peras jeruk ke dalam air dan warna berubah
menjadi kuning. Dalam larutan ammonia warna indikator tersebut berubah menjadi merah.
Gambar 6.11 Pengujian pH air kolam](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-28-320.jpg)
![139
Untuk menjelaskan perubahan warna ini, kita lihat terbentuknya warna kuning dari
indikator asam fenol merah, Hin, dan terbentuknya warna merah indikator basa, In-
.
Kesetimbangan terjadi diantara keduanya, dengan konsentrasi kesetimbangan Hin dan In-
tergantung pada [H3O+] dan pH.
Hin + H2O H3O+
+ In-
Kuning Merah
Secara umum: Hin + H2O H3O+
+ In-
(warna A) (warna B)
Sehingga:
Transisi warna asam ke warna basa terjadi pada daerah pH atau Interval warna indikator,
seperti pada Tabel dan Gambar berikut.
TABEL 6.4 INDIKATOR
Indikator
Warna
pKin
Daerah pH
(Interval warna)
Asam Basa
Timol Biru Merah Kuning 1,5 1,2 – 2,8
Metil Jingga Merah Kuning 3,7 3,2 – 4,4
Bromkesol Hijau Kuning Biru 4,7 3,8 – 5,4
Metil Merah Kuning Merah 5,1 4,8 – 6,0
Bromtimol Biru Kuning Biru 7,0 6,0 – 7,6
Fenol Merah Kuning Merah 7,9 6,8 – 8,4
Fenolftalein Tidak Berwarna Merah 9,4 8,2 – 10,0
Gambar 6.12.Rentang pH masing-
masing indikator
pH = pKin + log
B
A
a
a
n
n
r
a
w
r
a
w](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-29-320.jpg)


![143
+
O
3
H
l
o
m
m
5
L
m
0
3
4
4
(2) Setelah penambahan 10 mL NaOH 0,5 M (titik tengah penetralan). Setengah dari
HCl mengalami penetralan, setengah yang tersisa.
(3) Setelah penambahan 20 mL NaOH 0,5 M (titik ekivalen). Tidak ada asam maupun
basa yang ada dalam larutan.
(4) Setelah penambahan 21 mL NaOH 0,5 M (setelah titik ekivalen). Titran berlebih ada.
Penyelesaian
a. Kelarutan molar, S = 2,09/136 = 1,54 x 10-2 mol/L
Reaksi: CaSO4 (s) Ca2+
+ SO 2-
Ksp = [Ca2+] [SO 2] = S2 Ksp = (1,54 x 10-2)2
Ksp = 2,4 x 10-4
b. (1) Karena HCl asam kuat, HCl terionisasi secara sempurna. Untuk itu, larutan
mula-mula mempunyai [H3O+
] = 0,5 M, dan
pH = - log [H3O+
] = -log (0,5) = 0,301.
(2) Jumlah H3O+
yang dititrasi adalah: 20 mL x 0,5 mmol H3O+
/mL = 10 mmol
H3O+
Jumlah OH-
dalam 10 mL NaOH 0,5 M adalah:
10 mL x 0,5 mmol OH-
/mL = 5 mmol OH-
Kita dapat menyajikan reaksi penetralan dengan cara sebagai berikut.
H3O+
+ OH-
2 H2O
Jumlah mula-mula, mmol 10
Penambahan, mmol 5
Perubahan,mmol -5 -5
Setelah bereaksi, mmol 5 0
Volume total dari 20 mL + 10 mL = 30 mL, dan
[H3O+
] = = 0,17 M; maka pH = -log [H3O+
] = - log 0,17 = 0,77
(3) Larutan yang terjadi adalah NaCl (aq). Karena tidak ada Na+
atau Cl-
yang
terhidrolisis, maka pH larutan = 7,00
(4) Jumlah OH-
dalam 21 mL dari NaOH 0,5 M adalah: 21 mL x 0,5 mmol OH-
/mL = 10,5
mmol OH-
. Maka:
H3O+
+ OH-
2 H2O
Jumlah mula-mula, mmol 10
Penambahan, mmol 10,5
Perubahan,mmol -10 -10](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-33-320.jpg)
![144
︵
︶+
O
L
3
m
H
l
1
o
m
m
5
,
0
2
+
0
2
Setelah bereaksi, mmol 0 0,5
Konsentrasi OH-
, pOH dan pH nya adalah:
OH- = = 0,01 M; maka pOH = -log [OH-] = -log 0,01 = 2
pH = 14 – pOH = 14 – 2 = 12
Latihan Soal 9
a. Diketahui Ksp AgBr pada 250C adalah 7,7 x 10-13. hitung kelarutan AgBr dalam g/L.
b. Untuk titrasi yang telah digambarkan dalam contoh b, tetukan pH setelah penambahan
volume NaOh 0,5M berikut: (1) 19,90 mL; (2) 19,99 mL; (3) 20,01 mL; (4) 20,10 mL.](https://image.slidesharecdn.com/babvilarutanrev-221218010132-e36022d6/85/BAB-VI-LARUTAN-rev-docx-34-320.jpg)