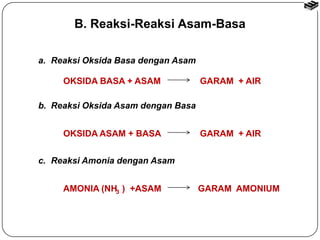
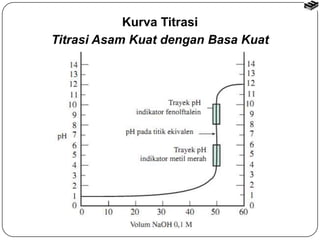
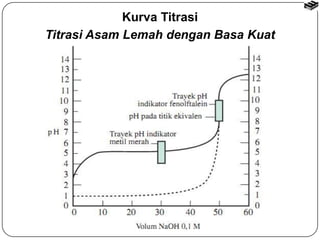
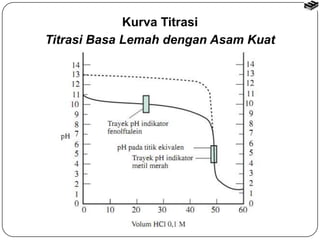
Bab 6 membahas stoikiometri reaksi dan titrasi asam-basa. Termasuk reaksi asam-basa, reaksi pergantian, dan reaksi logam dengan asam. Metode penghitungan stoikiometri untuk menentukan jumlah produk reaksi dengan mempertimbangkan pereaksi pembatas. Titrasi asam-basa digunakan untuk mengukur konsentrasi larutan dan kurvanya bergantung pada jenis asam dan basa.