Dokumen ini menjelaskan laporan praktikum tentang penentuan kadar keasaman dalam cuka menggunakan titrasi volumetri dan potensiometri. Metode titrasi melibatkan penggunaan asam oksalat dan NaOH, dengan pengukuran dilakukan secara manual dan menggunakan pH meter. Hasil percobaan menunjukkan konsentrasi kadar cuka murni serta ketelitian pengukuran yang dicapai.
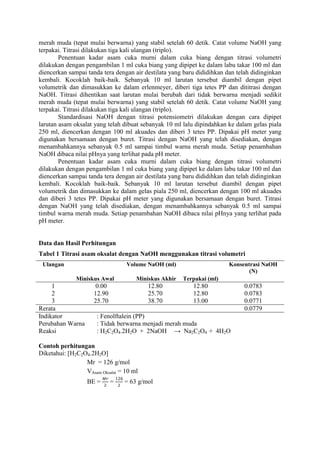
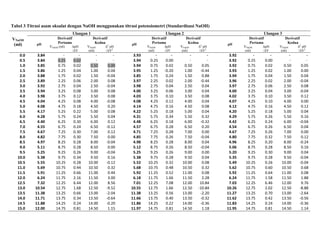
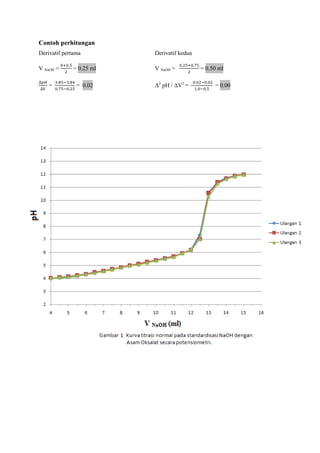
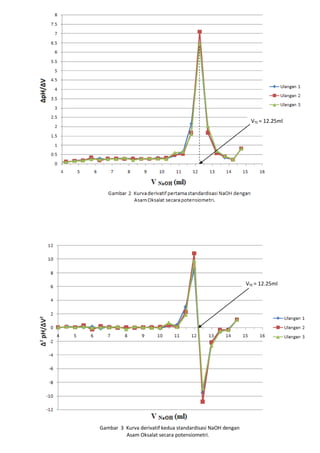
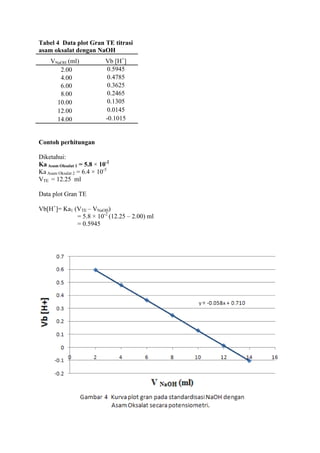
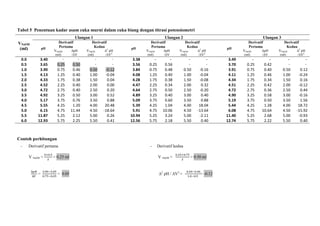
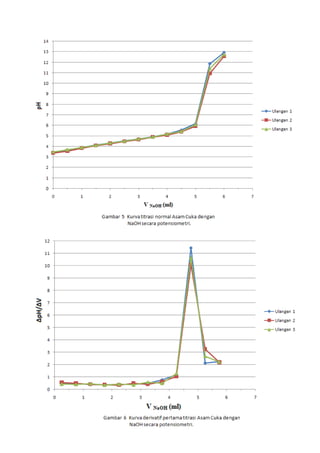
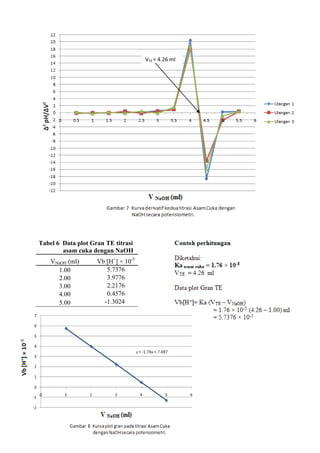
![LAPORAN PRAKTIKUMNama: Dumas Flis Tang<br />KIMIA ANALITIK 2NIM: G44080022<br />Kelompok : A (Pagi)<br />Asisten: Mohamad Rafi, S.Si, M.Si.<br />PJP: Mohamad Rafi, S.Si, M.Si.<br />Hari/Tanggal : 27 April 2010<br />Waktu: 09.00 - 12.00 WIB<br />PENENTUAN KEASAMAN DALAM CUKA DENGAN<br />TITRASI VOLUMETRI DAN POTENSIOMETRI<br />Prinsip Percobaan <br />Analisis kuantitatif mengenai reaksi penetralan asam-basa yang umumnya dilakukan adalah volumetri atau yang biasa disebut dengan titrimetri. Titrimetri menggunakan volume titran sebagai sinyal (Harvey 2000). Titran kita teteskan dari suatu buret ke dalam suatu erlenmeyer yang mengandung titrat. Selesainya suatu reaksi titrasi dapat dilihat karena terjadi perubahan warna. Perubahan ini dapat dihasilkan oleh larutan standarnya sendiri atau karena penambahan suatu zat yang disebut indikator. Titik dimana terjadinya perubahan warna indikator disebut titik akhir titrasi. Secara ideal titik akhir titrasi seharusnya sama dengan titik akhir teoritis (titik ekuivalen). Namun, pada prakteknya selalu terjadi sedikit perbedaan yang disebut kesalahan titrasi (Syukri 1999).<br />Titik akhir dalam titrasi potensiometri dapat dideteksi dengan menetapkan volume dimana terjadi perubahan potensial yang relatif besar ketika ditambahkan titran. Pada titrasi secara manual, potensial diukur setelah penambahan titran secara berurutan, dan hasil pengamatan digambarkan pada suatu kertas grafik terhadap volume titran untuk diperoleh suatu kurva titrasi. Umumnya suatu potensiometer sederhana dapat digunakan untuk proses ini, namun jika tidak ada, akan digunakan pH meter. Penggunaan pH meter ini telah menjadi demikian biasa untuk semua jenis titrasi (Basset 1994).<br />Tujuan Percobaan<br />Percobaan bertujuan menentukan kadar keasaman dalam cuka menggunakan titrasi volumetri dan potensiometri.<br />Prosedur percobaan<br />Preparasi bahan baku primer asam oksalat (H2C2O4.2H2O) 0.1 N dilakukan dengan penimbangan asam oksalat sebanyak 0.3157 gram dan 0.3156 gram dengan neraca analitik menggunakan gelas piala, tambahkan 30 ml akuades kedalam masing-masing gelas, kemudian diaduk hingga larut, setelah itu dimasukkan ke dalam labu takar 50 ml masing-masing larutan dan tera dengan aquades dan dikocok hingga homogen. Konsentrasi larutan sebesar 0.1 N.<br />Standardisasi NaOH dengan titrasi volumetri dilakukan dengan cara buret yang akan digunakan dicuci dengan menggunakan akuades lalu dibilas dengan sedikit NaOH, kemudian dikeringkan. Larutan asam oksalat diambil dengan pipet volumetrik 10 ml kedalam erlenmeyer, ditambah tiga tetes indikator fenolftalein, kemudian dititrasi dengan larutan NaOH. Titrasi dihentikan saat larutan mulai berubah dari tidak berwarna menjadi sedikit merah muda (tepat mulai berwarna) yang stabil setelah 60 detik. Catat volume NaOH yang terpakai. Titrasi dilakukan tiga kali ulangan (triplo).<br />Penentuan kadar asam cuka murni dalam cuka biang dengan titrasi volumetri dilakukan dengan pengambilan 1 ml cuka biang yang dipipet ke dalam labu takar 100 ml dan diencerkan sampai tanda tera dengan air destilata yang baru dididihkan dan telah didinginkan kembali. Kocoklah baik-baik. Sebanyak 10 ml larutan tersebut diambil dengan pipet volumetrik dan dimasukkan ke dalam erlenmeyer, diberi tiga tetes PP dan dititrasi dengan NaOH. Titrasi dihentikan saat larutan mulai berubah dari tidak berwarna menjadi sedikit merah muda (tepat mulai berwarna) yang stabil setelah 60 detik. Catat volume NaOH yang terpakai. Titrasi dilakukan tiga kali ulangan (triplo).<br />Standardisasi NaOH dengan titrasi potensiometri dilakukan dengan cara dipipet larutan asam oksalat yang telah dibuat sebanyak 10 ml lalu dipindahkan ke dalam gelas piala 250 ml, diencerkan dengan 100 ml akuades dan diberi 3 tetes PP. Dipakai pH meter yang digunakan bersamaan dengan buret. Titrasi dengan NaOH yang telah disediakan, dengan menambahkannya sebanyak 0.5 ml sampai timbul warna merah muda. Setiap penambahan NaOH dibaca nilai pHnya yang terlihat pada pH meter.<br />Penentuan kadar asam cuka murni dalam cuka biang dengan titrasi volumetri dilakukan dengan pengambilan 1 ml cuka biang yang dipipet ke dalam labu takar 100 ml dan diencerkan sampai tanda tera dengan air destilata yang baru dididihkan dan telah didinginkan kembali. Kocoklah baik-baik. Sebanyak 10 ml larutan tersebut diambil dengan pipet volumetrik dan dimasukkan ke dalam gelas piala 250 ml, diencerkan dengan 100 ml akuades dan diberi 3 tetes PP. Dipakai pH meter yang digunakan bersamaan dengan buret. Titrasi dengan NaOH yang telah disediakan, dengan menambahkannya sebanyak 0.5 ml sampai timbul warna merah muda. Setiap penambahan NaOH dibaca nilai pHnya yang terlihat pada pH meter.<br />Data dan Hasil Perhitungan<br />Tabel 1 Titrasi asam oksalat dengan NaOH menggunakan titrasi volumetri<br />UlanganVolume NaOH (ml)Miniskus Awal Miniskus AkhirTerpakai (ml)Konsentrasi NaOH (N)10.0012.8012.800.0783212.9025.7012.800.0783325.7038.7013.000.0771Rerata 0.0779<br />Indikator: Fenolftalein (PP)<br />Perubahan Warna: Tidak berwarna menjadi merah muda<br />Reaksi: H2C2O4.2H2O + 2NaOH -> Na2C2O4 + 4H2O<br />Contoh perhitungan<br />Diketahui: [H2C2O4.2H2O]<br /> Mr = 126 g/mol<br /> VAsam Oksalat = 10 ml<br /> BE = Mr2 = 1262 = 63 g/mol<br />Bobot asam oksalat yang harus ditimbang<br /> N = massa BE ×1000V 0.1 = massa 63 × 100050 ml<br />Massa = 0.3150 gram<br />Bobot asam oksalat yang ditimbang = 0.3157 gram<br />NAsam Oksalat = Bobot asam oksalatBE × 100050 <br />NAsam Oksalat = 0,3157 gram63 × 100050<br />NAsam Oksalat = 0.1002 N<br />Bobot asam oksalat yang ditimbang = 0.3156 gram<br />NAsam Oksalat = Bobot asam oksalatBE x 100050 <br />NAsam Oksalat = 0,3156 gram63 x 100050<br />NAsam Oksalat = 0.1002 N<br />Maka,<br />NAsam Oksalat = N Asam Oksalat1+ N Asam Oksalat22 = 0.1002+0.10022 = 0.1002 N<br />Ulangan 1<br />VNaOH . NNaOH = VAsam Oksalat . NAsam Oksalat<br />12.8 × NNaOH = 10 × 0.1002 N<br />NNaOH = 0.0783 N<br />Rerata N = 0.0783+0.0783+0.07713 = 0.0779 N<br />Sd=i=13(x-x)2n-1 = 0.0007<br />Ketelitian = (1-SdX )x100%= 99.10 %<br />Tabel 2 Penentuan kadar asam cuka murni dalam cuka biang dengan titrasi volumetri<br />Ulangan Volume NaOH (ml)Miniskus Awal Miniskus AkhirTerpakai (ml)Konsentrasi Cuka (N)Kadar Cuka (%b/v)1 0.00 5.205.200.40512.432 5.2010.305.100.39732.38310.3015.505.200.40512.43Rerata0.40252.41<br />Indikator: Fenolftalein (PP)<br />Perubahan Warna: Tidak berwarna menjadi merah muda<br />Reaksi: CH3COOH + NaOH -> CH3COONa + H2O<br />Contoh perhitungan<br />Diketahui: [CH3COOH] = 0.1 N<br /> Mr = 60 g/mol<br /> VCuka = 10 ml<br /> BE = BM = Mr = 60 g/mol<br /> <br />Ulangan 1<br />Konsentrasi cuka dalam pengenceran 50 ml akuades<br />VNaOH.NNaOH = Vcuka.Ncuka<br />5.20 × 0.0779 = 10 × Ncuka<br />Ncuka pengenceran = 0.04051 N<br />Konsentrasi cuka dalam 5 ml cuka biang<br />Vcuka pengenceran .Ncuka pengenceran = Vcuka.Ncuka<br />50 × 0.04051 = 5 × Ncuka<br />Ncuka = 0.4051 N<br />Kadar cuka murni dalam 5 ml cuka biang<br />N=massaBE×1000V <br />0.4051 N= massa60×10005<br />Bobot cuka murni = 0.1215 gram / 5ml<br />(%b/v) = 2.43%<br />Rerata konsentrasi cuka (N) = 0.4051+0.3973+0.40513 = 0.4025 N<br />Sd=i=13(x-x)2n-1 = 0.0045 Ketelitian = (1-SdX )x100%= 98.89 %<br />Rerata kadar cuka (gram) = 2.43+2.38+2.433 = 2.41 %<br /> Sd=i=13(x-x)2n-1 = 0.0289 Ketelitian = (1-SdX )x100%= 98.80 %<br />Tabel 3 Titrasi asam oksalat dengan NaOH menggunakan titrasi potensiometri (Standardisasi NaOH)<br />VNaOH (ml) Ulangan 1 Ulangan 2 Ulangan 3 pHDerivatif PertamaDerivatifKedua pHDerivatif PertamaDerivatif Kedua pHDerivatifPertamaDerivatif KeduaVNaOH (ml)ΔpH /ΔVVNaOH (ml)Δ2 pH /ΔV2VNaOH (ml)ΔpH /ΔVVNaOH (ml)Δ2 pH /ΔV2VNaOH (ml)ΔpH /ΔVVNaOH (ml)Δ2 pH /ΔV20.03.84- - - - 3.93- - - - 3.92- - - -0.53.840.250.02- - 3.940.250.00- - 3.920.250.00 -- 1.03.850.750.020.500.003.940.750.020.500.053.920.750.020.500.051.53.861.250.041.000.043.951.25-0.201.00-0.443.931.250.021.000.002.03.881.750.021.50-0.043.851.750.241.500.883.941.750.041.500.042.53.892.250.062.000.083.972.250.022.00-0.443.962.250.022.00-0.043.03.922.750.042.50-0.043.982.750.042.500.043.972.750.062.500.083.53.943.250.083.000.084.003.250.063.000.044.003.250.043.00-0.044.03.983.750.123.500.084.033.750.103.500.084.023.750.103.500.124.54.044.250.084.00-0.084.084.250.124.000.044.074.250.104.000.005.04.084.750.184.500.204.144.750.164.500.084.124.750.164.500.125.54.175.250.225.000.084.225.250.185.000.044.205.250.185.000.046.04.285.750.245.500.044.315.750.345.500.324.295.750.265.500.166.54.406.250.306.000.124.486.250.186.00-0.324.426.250.246.00-0.047.04.556.750.246.50-0.124.576.750.286.500.204.546.750.266.500.047.54.677.250.307.000.124.717.250.287.000.004.677.250.267.000.008.04.827.750.307.500.004.857.750.267.50-0.044.807.750.327.500.128.54.978.250.288.00-0.044.988.250.288.000.044.968.250.208.00-0.249.05.118.750.288.500.005.128.750.268.50-0.045.068.750.288.500.169.55.259.250.269.00-0.045.259.250.269.000.005.209.250.309.000.0410.05.389.750.349.500.165.389.750.289.500.045.359.750.289.50-0.0410.55.5510.250.2810.00-0.125.5210.250.3210.000.085.4910.250.2610.00-0.0411.05.6910.750.4410.500.325.6810.750.4810.500.325.6210.750.6010.500.6811.55.9111.250.6611.000.445.9211.250.5211.000.085.9211.250.6411.000.0812.06.2411.752.1611.503.006.1811.751.6611.502.286.2411.751.5811.501.8812.57.3212.256.4412.008.567.0112.257.0812.0010.847.0312.256.4612.009.7613.010.5412.751.6812.50-9.5210.5512.751.6612.50-10.8410.2612.752.0212.50-8.8813.511.3813.250.6613.00-2.0411.3813.250.5613.00-2.2011.2713.250.7013.00-2.6414.011.7113.750.3413.50-0.6411.6613.750.4013.50-0.3211.6213.750.4213.50-0.5614.511.8814.250.2414.00-0.2011.8614.250.2214.00-0.3611.8314.250.2414.00-0.3615.012.0014.750.8114.501.1511.9714.750.8114.501.1811.9514.750.8114.501.14<br />Contoh perhitungan<br />Derivatif pertama Derivatif kedua<br />V NaOH = 0+0.52 = 0.25 mlV NaOH QUOTE 2.5+0.52 = 0.25+0.752 = 0.50 ml <br />∆pH∆V = 3.85-3.840.75-0.25 = 0.02 Δ2 pH / ΔV2 = 0.02-0.021.0-0.5 = 0.00<br /> <br />-276225137160<br />-47625-676275<br />VTE = 12.25mlVTE = 12.25ml-476254328160Gambar 3 Kurva derivatif kedua standardisasi NaOH dengan Asam Oksalat secara potensiometri.<br />Tabel 4 Data plot Gran TE titrasi<br />asam oksalat dengan NaOH<br />VNaOH (ml)Vb [H+] 2.000.5945 4.000.4785 6.000.3625 8.000.246510.000.130512.000.014514.00-0.1015<br />Contoh perhitungan<br />Diketahui:<br />Ka Asam Oksalat 1 = 5.8 × 10-2<br />Ka Asam Oksalat 2 = 6.4 × 10-5<br />VTE = 12.25 ml<br />Data plot Gran TE<br />747712520320<br />Vb[H+]= Ka1 (VTE – VNaOH)<br />= 5.8 × 10-2 (12.25 – 2.00) ml<br />= 0.5945<br />Tabel 5 Penentuan kadar asam cuka murni dalam cuka biang dengan titrasi potensiometri<br />VNaOH (ml) Ulangan 1 Ulangan 2 Ulangan 3 pHDerivatif PertamaDerivatifKedua pHDerivatif PertamaDerivatif Kedua pHDerivatifPertamaDerivatif KeduaVNaOH (ml)ΔpH /ΔVVNaOH (ml)Δ2 pH /ΔV2VNaOH (ml)ΔpH /ΔVVNaOH (ml)Δ2 pH /ΔV2VNaOH (ml)ΔpH /ΔVVNaOH (ml)Δ2 pH /ΔV20.03.40- - - - 3.38- - - - 3.49- - - -0.53.650.250.50- - 3.560.250.56- - 3.700.250.42 -- 1.03.900.750.460.50-0.123.840.750.480.50-0.163.910.750.400.500.121.54.131.250.401.00-0.044.081.250.401.00-0.044.111.250.461.00-0.242.04.331.750.381.500.044.281.750.381.50-0.084.341.750.341.500.162.54.522.250.402.000.004.472.250.342.000.324.512.250.422.00-0.123.04.722.750.402.500.204.642.750.502.50-0.204.722.750.362.500.443.54.923.250.503.000.524.893.250.403.000.404.903.250.583.00-0.164.05.173.750.763.500.885.093.750.603.500.885.193.750.503.501.564.55.554.251.204.0020.485.394.251.044.0018.045.444.251.284.0018.725.06.154.7511.444.50-18.645.914.7510.064.50-13.646.084.7510.644.50-15.925.511.875.252.125.000.2610.945.253.245.00-2.1111.405.252.685.00-0.936.012.935.752.255.500.4112.565.752.185.500.4012.745.752.225.500.40<br />Contoh perhitungan<br /> Derivatif pertama - Derivatif kedua V NaOH = 0+0.52 = 0.25 ml V NaOH QUOTE 2.5+0.52 = 0.25+0.752 = 0.50 ml <br />∆pH∆V = 3.90-3.650.75-0.25 = 0.05 Δ2 pH / ΔV2 = 0.40-0.461.0-0.5= -0.12<br />-142875-57150<br />-142875149225<br />9525-600075VTE = 4.26 ml<br />3190875124460<br />Tabel 6 Data plot Gran TE titrasi<br /> asam cuka dengan NaOH<br />VNaOH (ml)Vb [H+] × 10-51.005.73762.003.97763.002.21764.000.45765.00 -1.3024<br />-466725125095<br />Tabel 7 Penentuan kadar asam cuka murni dalam cuka biang dengan titrasi potensiometri<br />UlanganVolume TE (ml)Konsentrasi Cuka (N)Kadar Cuka (%b/v)14.250.33111.9924.260.33191.9934.270.33262.00Rerata4.260.33191.99<br />Indikator: Fenolftalein (PP)<br />Perubahan Warna: Tidak berwarna menjadi merah muda<br />Reaksi: CH3COOH + NaOH -> CH3COONa + H2O<br />Contoh perhitungan<br />Diketahui: [CH3COOH] = 0.1 N<br /> Mr = 60 g/mol<br /> VCuka = 10 ml<br /> BE = BM = Mr = 60 g/mol<br /> <br />Ulangan 1<br />Konsentrasi cuka dalam pengenceran 50 ml<br />VNaOH.NNaOH = Vcuka.Ncuka<br />4.25 × 0.0779 = 10 × Ncuka<br />Ncuka pengenceran = 0.03311 N<br />Konsentrasi cuka dalam 5 ml cuka biang<br />Vcuka pengenceran .Ncuka pengenceran = Vcuka.Ncuka<br />50 × 0.03311 = 5 × Ncuka<br />Ncuka = 0.3311 N<br />Kadar Cuka murni dalam 5 ml cuka biang<br />N= massaBE×1000V <br />0.3311 N= massa60×10005<br />Bobot cuka murni = 0.0993 gram / 5 ml<br />(%b/v) = 1.99%<br />Rerata konsentrasi cuka (N) = 0.3311+0.3319+0.33263 = 0.3319 N<br />Sd=i=13(x-x)2n-1 = 0.00075 Ketelitian = (1-SdX )x100%= 99.77 %<br />Rerata kadar cuka (%b/v) = 1.99+1.99+2.003 = 1.99 %<br /> Sd=i=13(x-x)2n-1 = 0.0058 Ketelitian = (1-SdX )x100%= 99.69 %<br />Tabel 8 Perbandingan kadar asam cuka murni <br /> antara titrasi volumetri dengan potensiometri<br />UlanganKadar Cuka (%b/v)volumetripotensiometri12.431.9922.381.9932.432.00Rerata2.411.99Sd0.0289 0.0058<br />Pembahasan<br />Penentuan keasaman dalam cuka dapat dilakukan dengan analisis kuantitatif secara volumetri dan potensiometri. Cuka yang memiliki rumus molekul CH3COOH merupakan asam lemah yang jika dititrasi harus menggunakan titran yang bersifat basa, salah satunya NaOH yang merupakan basa kuat. Namun konsentrasi NaOH tidak dapat dipastikan secara teliti karena NaOH bukan bahan baku primer, NaOH bersifat higroskopis dan mudah bereaksi dengan CO2 di udara. Hal ini dapat diatasi dengan standardisasi menggunakan bahan baku primer yang telah diketahui konsentrasi/kenormalannya dengan teliti yaitu asam oksalat H2C2O4.2H2O.<br />Standardisasi NaOH dengan asam oksalat menghasilkan reaksi H2C2O4.2H2O + 2NaOH -> Na2C2O4 + 2H2O. Indikator asam basa yang digunakan adalah fenolftalein, memiliki trayek pH 8.3-10.0. Bobot asam oksalat yang digunakan adalah 0.3157 gram dan 0.3156 gram dan normalitas asam oksalat adalah 0.1002 N. Konsentrasi NaOH yang didapat dihitung dari rerata 3 kali ulangan adalah sebesar 0.0779 N. Titik akhir terjadi dengan ditandai perubahan warna pada larutan dari tidak berwarna menjadi merah muda dan volume titran yang terpakai adalah 12.80 ml, 12.80 ml, dan 13.00 ml. Titrasi dihentikan saat titik ekuivalen tercapai atau tepat saling menghabiskan, volume titik akhir yang didapatkan lebih besar dari titik ekuivalen sehingga terjadi kesalahan positif. Dilihat dari ketelitian berdasarkan rerata dan standar deviasi, didapat ketelitian yang cukup baik yaitu 99.10 %, ini menandakan proses standardisasi cukup baik.<br />Titrasi asam oksalat dengan NaOH (standardisasi NaOH) menggunakan potensiometri, volume NaOH yang ditambahkan sedikit demi sedikit ke titrat (asam oksalat) menghasilkan perubahan pH, sehingga didapatkan hubungan volume NaOH dengan pH pada Gambar 1. Kurva yang dihasilkan adalah semakin banyak volume titran yang ditambahkan, maka semakin meningkat pHnya. Pada volume sekitar 12.5ml-13.0ml terlihat peningkatan pH yang drastis dari pH 7 menjadi 10. Hal ini menandakan bahwa titik ekivalen berada disekitar dan hasil titrasi atau titran tersebut bersifat basa. Asam oksalat merupakan asam poliprotik, karena memiliki dua proton. Asam oksalat akan tepat saling menghabiskan dengan NaOH dengan dua tahap reaksi. Namun, dalam percobaan hanya terjadi reaksi pertama yang ditandai dengan terjadi titik ekuivalen pada volume sekitar 12.25 ml.Titik ekivalen ini dapat ditentukan dengan menggunakan kurva derivatif pertama pada Gambar 2 dan kurva derivatif kedua pada Gambar 3. Kurva derivatif kedua akan lebih tepat dalam menentukan titik akhir titrasi dibandingkan dengan kurva derivatif pertama, karena titik ekuivalennya diperoleh dari titik potong kurva dengan sumbu X yaitu pada volume NaOH mencapai 12.25 ml, hal ini menunjukan bahwa titik akhir titrasi terjadi pada volume yang sama dengan titik ekuivalen yaitu 12.25 ml.<br />Penentuan kadar cuka murni (asam asetat) dalam cuka biang dilakukan dengan volumetri, terlebih dahulu cuka biang yang digunakan harus diencerkan karena cuka biang tidak bisa dititrasi langsung. Pengenceran ini menggunakan air destilata yang telah dididihkan lalu kemudian didinginkan kembali dengan maksud agar air destilata tersebut tidak mengandung CO2 yang dapat mempengaruhi keasaman cuka. Asam asetat akan bereaksi dengan NaOH menghasilkan garam CH3COONa dan air. Asam cuka merupakan asam monoprotik, sehingga 1 mol asam asetat akan tepat saling menghabiskan dengan 1 mol NaOH dalam satu tahap dan terjadi pada satu titik ekuivalen. Secara volumetri, titik ekuivalen terjadi pada rerata volume NaOH yaitu 5.17 ml maka konsentrasi NaOH digunakan dalam menentukan konsentrasi cuka pada pengenceran 50 ml yaitu 0.0779 N, sedangkan rerata konsentrasi cuka murni dalam 5 ml cuka biang adalah 0.4025 N sehingga didapatkan rerata kadar cuka murni sebesar 2.41% (%b/v). Penentuan kadar asam cuka dengan potensiometri, didapat rerata titik ekuivalen terjadi pada volume 4.26 ml yang dilihat dari kurva derivatif kedua, terlihat pada Gambar 7. Konsentrasi cuka murninya adalah 0.3319 N sehingga didapatkan kadar cuka murni sebesar 1.99% (%b/v).<br />Simpulan<br />Berdasarkan hasil percobaan dan pembahasan dapat disimpulkan bahwa penentuan kadar cuka murni dalam cuka biang dapat dilakukan dengan titrasi volumetri maupun potensiometri. Asam asetat yang bersifat asam dapat dititrasi dengan NaOH yang bersifat basa. Dalam menentukan titik akhir dapat dilakukan dengan menggunakan indikator asam-basa, cara derivatif dan plot gran. Titik ekuivalen dan kadar cuka murni dalam cuka biang dihasilkan tidak berbeda jauh dengan menggunakan kedua cara tersebut. Tujuan percobaan ini tercapai karena praktikan dapat menentukan kadar cuka murni dengan cara titrasi volumetri dan potensiometri serta menentukan titik akhir cukup baik.<br />Daftar Pustaka <br />Basset. 1994. TITRASI POTENSIOMETRI [terhubung berkala] http://forum.upi.edu/v3/index.php?PHPSESSID=6f9207c1f321918857ab72c9c3359120&action=profile;u=28139 [4 April 2010]<br />Harvey David. 2000. Modern Analitical Chemistry.USA: Mc Graw- Hill Co.<br />Syukri.1999. Kimia Dasar 2. Bandung: ITB<br />](https://image.slidesharecdn.com/asamcuka-110806011156-phpapp01/75/Asam-cuka-1-2048.jpg)