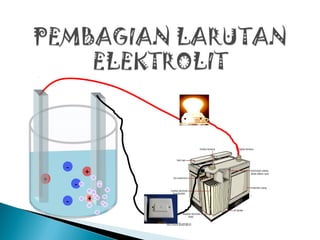
Dokumen ini membahas konsep oksidasi dan reduksi dalam reaksi kimia, serta pentingnya bilangan oksidasi dalam menentukan sifat zat. Selain itu, dijelaskan tentang larutan, jenis-jenis larutan elektrolit, dan karakteristik elektrolit kuat, lemah, serta non-elektrolit. Penjelasan juga mencakup contoh-contoh senyawa yang terkait dengan masing-masing kategori larutan.