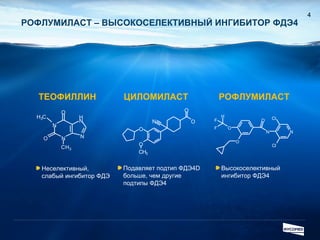
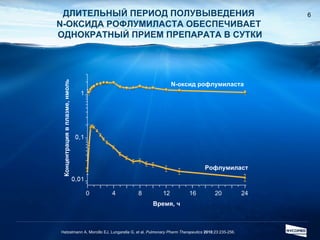
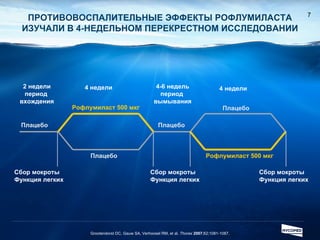
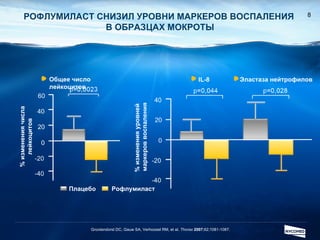
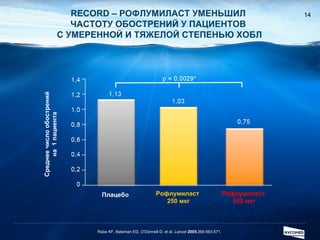
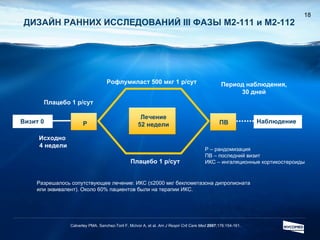
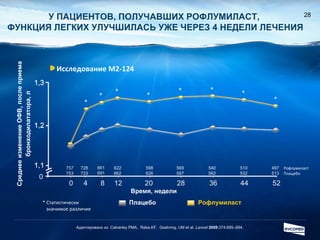
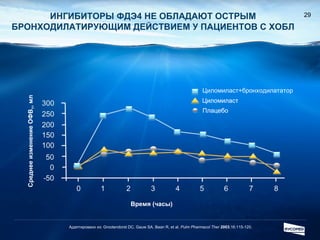
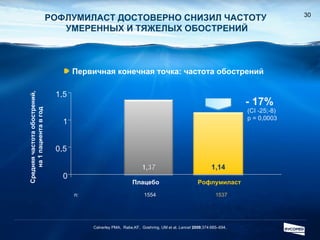
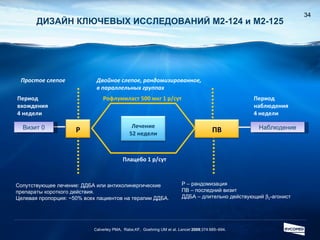
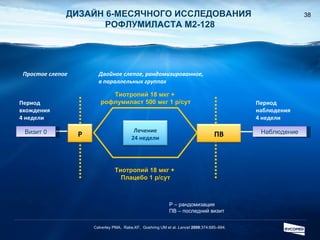
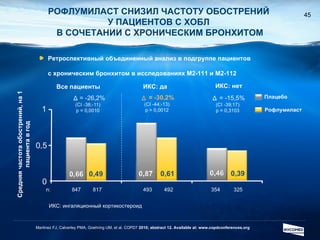
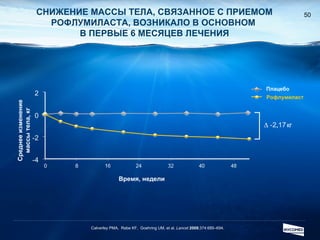
Документ обсуждает ингибиторы фосфодиэстеразы типа 4 (ФДЭ4), их роль в воспалительных процессах и клинические разработки, в частности рофлумиласта как высокоселективного ингибитора для лечения ХОБЛ. Рофлумиласт демонстрирует улучшение функции легких, снижение уровней маркеров воспаления и уменьшение частоты обострений у пациентов с ХОБЛ в клинических испытаниях. Современные ингибиторы ФДЭ4 имеют меньше побочных эффектов по сравнению с предыдущими препаратами, что делает их более перспективными для лечения данного заболевания.