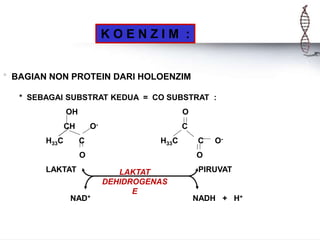
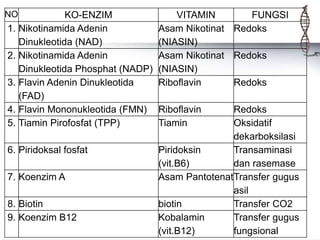
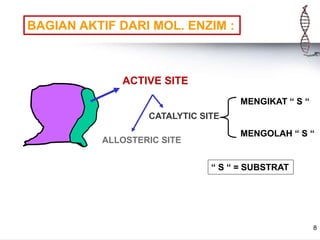
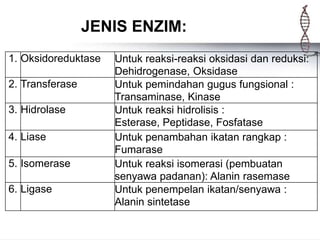
Enzim adalah protein yang berfungsi sebagai biokatalisator dalam berbagai reaksi kimia di dalam sel hidup, sangat spesifik dan memiliki daya katalitik yang tinggi. Enzim memerlukan koenzim dan kofaktor untuk berfungsi, dan tanpa enzim, reaksi biokimia tidak dapat terjadi, yang dapat menyebabkan penyakit. Berbagai faktor seperti suhu, pH, dan konsentrasi substrat mempengaruhi aktivitas enzim.











![MEKANISME KERJA ENZIM
REAKSI : E + S [ ES ] E + P
1. TEORI FISHER : ( KEY & LOCK THEORY )
pengikatan substrat dan enzim ditentukan oleh
persisnya struktur sisi aktif dan substrat
+ +
E S ES E P](https://image.slidesharecdn.com/2-230921012518-a7c4ce51/85/2-ENZIM_DAN_KOENZIM_pptx-pptx-14-320.jpg)

![16
2. Daniel – Koshland : Induced – fit
Enzim SUBSTRAT
[E-S]
E S
E
E
E
E
E
S
S
S
S
S
S
S](https://image.slidesharecdn.com/2-230921012518-a7c4ce51/85/2-ENZIM_DAN_KOENZIM_pptx-pptx-16-320.jpg)

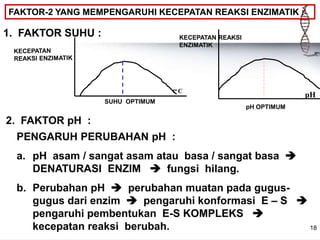
![19
3. FAKTOR KADAR SUBSTRAT & ENZIM
• Kadar S << kadar E penambahan S akan
menaikkan kecepatan reaksi enzim jenuh dengan
S kecepatan reaksi tidak meningkat lagi.
• Kadar E << kadar S penambahan E akan
meningkatkan kecepatan reaksi setelah terjadi
keseimbangan = penambahan E tidak akan
meningkatkan kecepatan reaksi.
REAKSI ENZIMATIK : E + S E + P
k1
k2
v1 = k1 [E] [S] v2 = k2 [E] [P]
v1 adalah kecepatan awal = saat mulai reaksi
v1 berbanding lurus dgn kadar substrat maupun kadar enzim.](https://image.slidesharecdn.com/2-230921012518-a7c4ce51/85/2-ENZIM_DAN_KOENZIM_pptx-pptx-19-320.jpg)