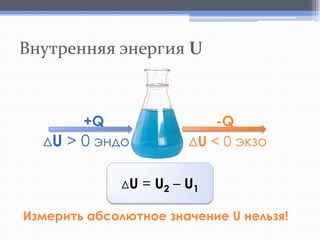
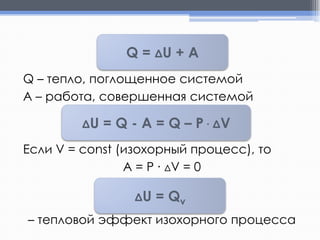
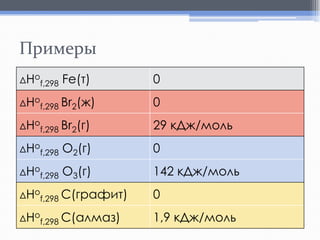
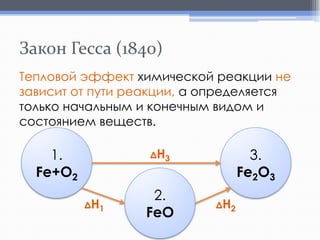
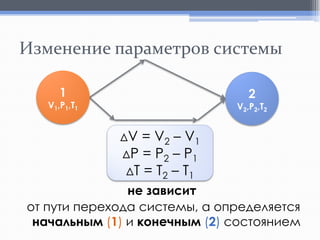
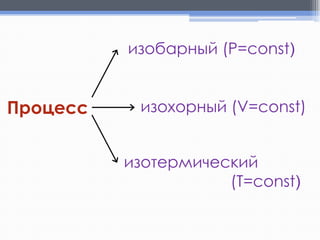
Лекция посвящена термохимии и охватывает основные понятия, такие как внутренняя энергия, энтальпия и термохимические уравнения. Рассматриваются законы Гесса и их следствия в контексте теплообмена при химических реакциях. Приводятся примеры стандартных энтальпий образования и сгорания веществ.












![Единицы измерения ΔH
[ΔН] = Дж, кДж
кал, ккал
1кал = 4,18 Дж](https://image.slidesharecdn.com/2-a-140301110554-phpapp01/85/2-15-320.jpg)