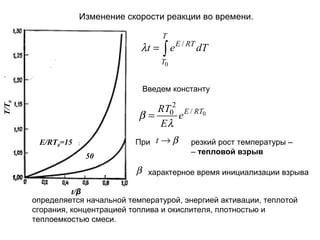
Документ охватывает кинетику химических реакций горения, включая уравнение реакции горения пропана и определение скорости химических реакций. Рассматривается закон Аррениуса, тепловые эффекты горения и их влияние на скорость реакции и температуру. Обсуждаются термодинамические аспекты, такие как изменение температуры и условия, приводящие к тепловым взрывам.