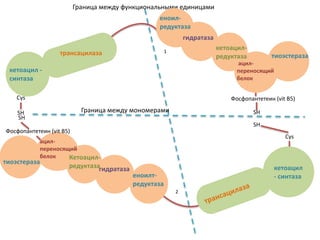
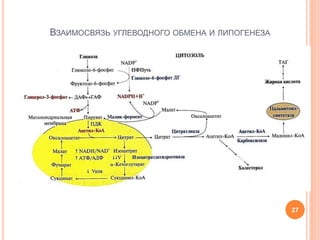
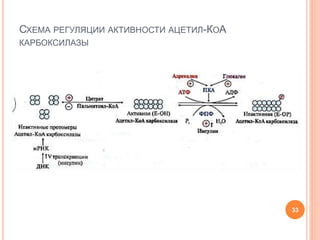
Документ представляет собой лекцию о липогенезе, объясняющую метаболические пути обмена липидов, их связь с ожирением и метаболическим синдромом. Основное внимание уделяется синтезу триацилглицеридов и высших жирных кислот, а также нарушениям, связанным с транспортом жиров в организме. Лекция также затрагивает взаимосвязь между углеводным обменом и липогенезом, роль инсулина и механизмы регуляции этих процессов.