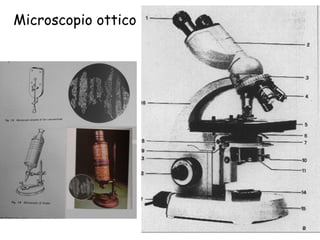
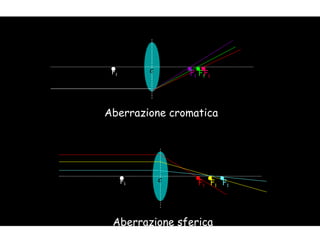
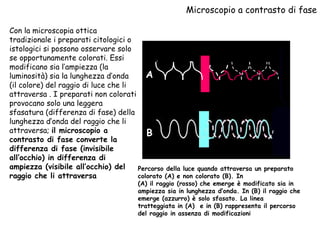
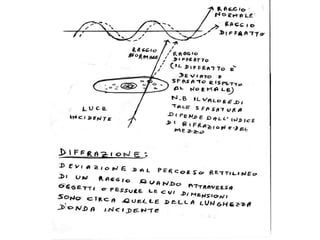
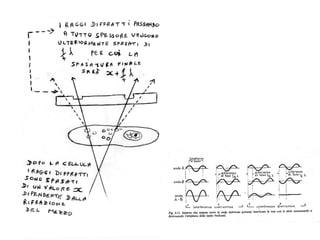
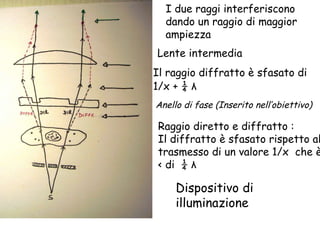
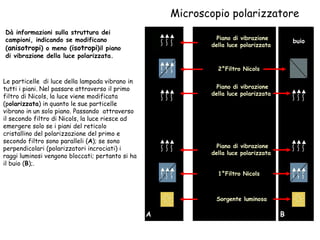
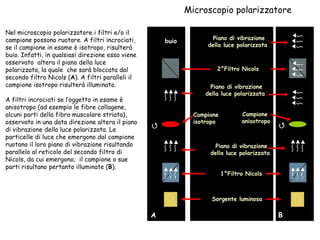
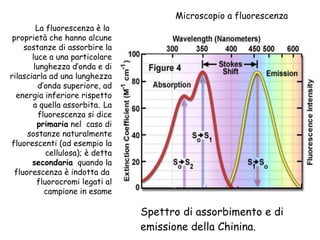
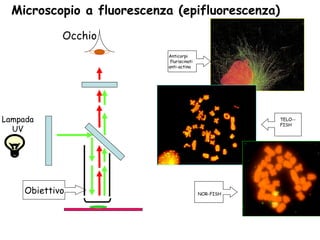
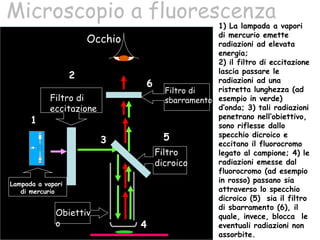
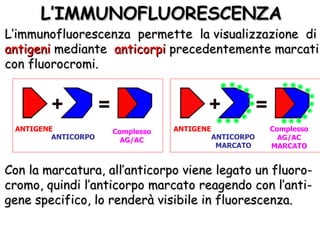
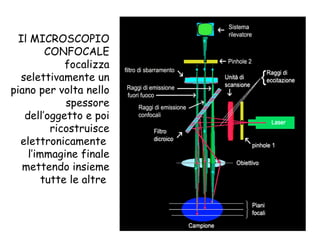
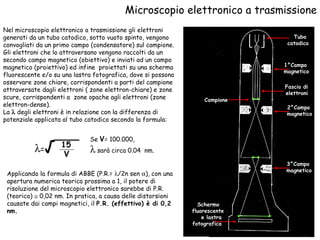
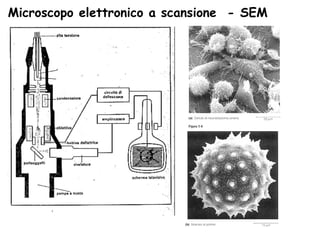
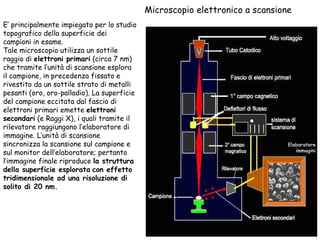
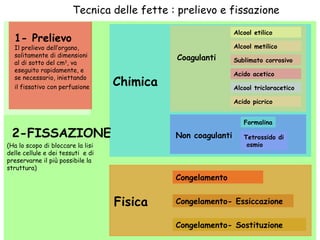
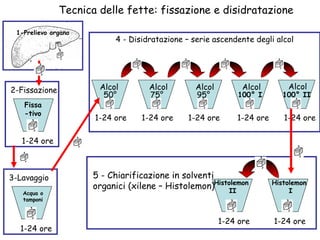
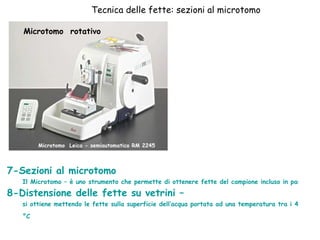
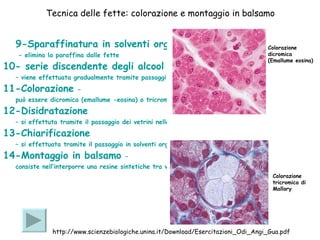
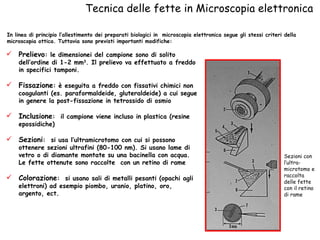
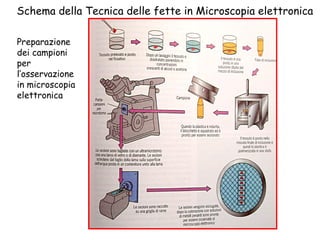
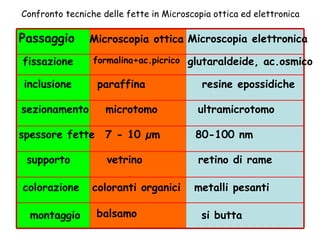
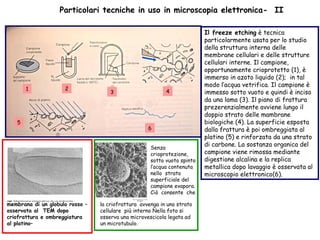
Il documento fornisce una panoramica approfondita sui microscopi ottici e elettronici, spiegando i vari tipi di obiettivi e oculari, nonché le tecniche per l'osservazione di campioni biologici, tra cui la microscopia a contrasto di fase e la microscopia a fluorescenza. Viene descritta in dettaglio la preparazione dei campioni, comprese le fasi di fissazione, disidratazione e inclusione in paraffina. Inoltre, si esamina la teoria di funzionamento di diversi microscopi, compresi quelli elettronici a scansione e a trasmissione.