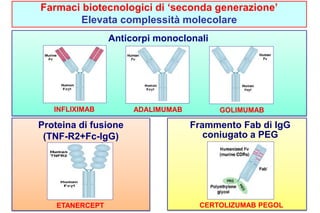
Il documento esplora la transizione dai farmaci tradizionali ai biotecnologici e biosimilari, descrivendo le differenze nella loro produzione e complessità. I farmaci biosimilari sono definiti come biotecnologici approvabili che devono dimostrare somiglianze biologiche e farmacologiche con il farmaco originale, dopo la scadenza del brevetto. Viene discussa anche la sostituibilità automatica dei biosimilari e le considerazioni per la loro utilizzazione clinica.