Документ охватывает платиновые металлы, включая их классификацию, историю открытия, минералы и проявления в окружающей среде. Также представлен анализ их химических и физических свойств, включая реакции окисления, и использование в разных отраслях. В документе рассматриваются токсичность соединений и методы получения чистых элементов, а также приведены задачи для самостоятельного решения по химии платины.





![Электронное строение атомов платиновых
металлов и их степени окисления
Элемент
Электронная
формула
Характерные
степени
окисления
Ru [Kr]4d7
5s1
+3, +4, +6, +8
Rh [Kr]4d8
5s1
+3
Pd [Kr]4d10
5s0
+2
Os [Xe]4f14
4d6
5s2
+6, +8
Ir [Xe]4f14
4d7
5s2
+3, +4
Pt [Xe]4f14
4d9
5s1
+2, +4
6](https://image.slidesharecdn.com/pt-161020130905/85/slide-6-320.jpg)


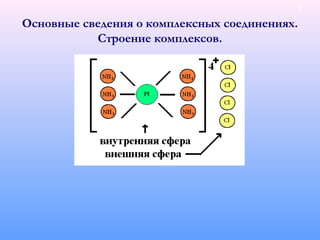
![Основные сведения о комплексных соединениях.
Классификация комплексов.
По заряду комплексного иона:
Катионные: [Al (H2
O)6]3+
, [Zn(NH3
)4
]2+
Анионные: [Al(OH)6
]3−
,[PtCl6
]2−
Нейтральные (без внешней сферы): [CrCl3
(NH3
)3
] [Fe(CO)5
],
Катионно – анионные: [Cr(H2
O)6
][Co(CN)6
]
По типу лиганда:
Аквакомплексы (лигандом является вода): [Al (H2
O)6
]3+
,[Сu(H2
O)4]2+
Ацидокомплексы (лигандами являются кислотные остатки): H2
[PtCl6
], [MnCl4
]2−
.
Гидроксокомплексы (лигандами являются ОН−
-ионы):[Mn(OH)6
]4−
, Na3
[Ga(OH)6
]
Карбонилы: в качестве лигандов выступают молекулы СО: [Fe (CO)]5
, [Pd(CO)4
]
Смешанные (содержат несколько разных лигандов): [CrCl3
(NH3
)3
]
Хелатные (клешневидные, циклические) – лиганд имеет не менее двух связей с
центральным атомом:
10](https://image.slidesharecdn.com/pt-161020130905/85/slide-10-320.jpg)




![Химические свойства платиновых
металлов
4. Не переводятся в раствор действием щелочей
5. Отношение к кислотам:
Не взаимодействуют с кислотами - Os, Ru, Ir, Rh
Растворяются в кислотах – окислителях – Pt, Pd
Pd + 4HNO3(конц) = Pd(NO3)2+ 2NO2+ 2H2O
3Pt + 4HNO3+ 18HCl = 3H2[PtCl6] + 4NO + 8H2O
6. Щелочное окисление в расплаве
Ru + 3NaNO3+ 2NaOH (ж) = Na2Ru+6
O4 + 3NaNO2+ H2O
Os + 3NaNO3+ 2NaOH (ж) = Na2OsO4+ 3NaNO2+ H2O
Ir+ 2NaNO3+ 2NaOH (ж)= Na2Ir+4
O3+ 2NaNO2+ H2O
Rh+ 2NaNO3+ 2NaOH (ж)= Na2Rh+4
O3+ 2NaNO2+ H2O](https://image.slidesharecdn.com/pt-161020130905/85/slide-15-320.jpg)

![OsO4 + 2NaOH = Na2[OsO4(OH)2]
RuO4 + 2NaOH = Na2[RuO4(OH)2]
RuO2= Ru+ O2(7000
C)
OsO2= Os + O2(200
C)
RuO4+ 14HCl + 4KCl = K4[Ru2OCl10] + 7H2O + 4Cl2
Гидроксиды платиновых металлов
MeCl4 +4H2O = Me(OH)4↓ +4HCl
4Na3[IrCl6] + NaOH + 2H2O + O2 = Ir(OH)4↓ + 2NaCl
2PtO3 = 2PtO2 + O2
PtO3+ HCl = Cl2+ H2[PtCl6] + H2O
K2[PtCl6] + KOH = Pt(OH)2 ↓ + 4KCl
Pt(OH)2= PtO +H2O
Комплексные соединения
Степень окисления + 2
КЧ = 4 (Pt, Pd) – аммиакаты, галогениды (прим. K2[PtCl4]
Степень окисления + 3
КЧ = 6 (Rh, Ir) – аммиакаты, галогениды (Rh(NH3)5(H2O))Cl3
Степень окисления + 4
КЧ = 6 (Ir, Rh, Ru) – ацидокомплеексы, аква-комплексы
17](https://image.slidesharecdn.com/pt-161020130905/85/slide-17-320.jpg)



