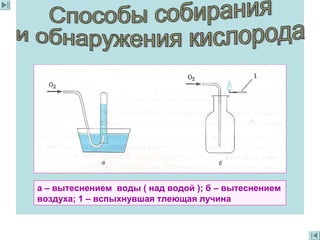
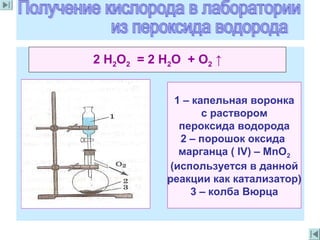
Документ описывает свойства и роли кислорода, включая его открытие, состав атмосферы и взаимодействия с другими элементами. Упоминается о кислороде как о главном окислителе, жизненно необходимом для дыхания организмов и многих химических процессов. Также обсуждаются методы получения кислорода и его применение в различных отраслях, включая медицину и металлургию.