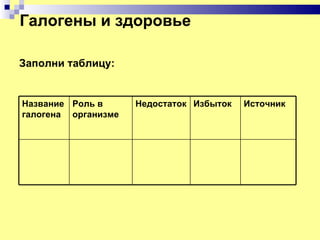
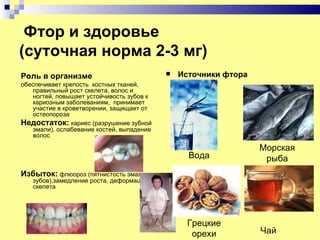
Документ посвящен элементам группы галогенов, включая их открытие, строение атомов, физические и химические свойства, а также роль в организме человека. Каждый из галогенов рассматривается в контексте его открытия, включая истории и химические реакции. Кроме того, документ выделяет важность галогенов для здоровья и их источники, а также последствия их недостатка и избытка в организме.