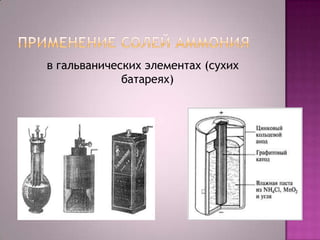
Документ рассматривает химические свойства и применение солей аммония, акцентируя внимание на их растворимости в воде и реакции с щелочами. Также упоминаются типичные применения, такие как использование в хлебопечении, удобрениях и при паянии металлов. В заключение подчеркивается важность азота в жизни и его связь с белками.