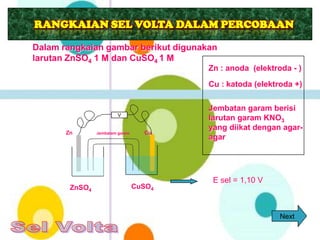
Dokumen tersebut membahas tentang standar kompetensi dan kompetensi dasar serta materi pelajaran tentang sistem elektrokimia yang melibatkan energi listrik, termasuk penjelasan tentang sel volta, indikator pembelajaran, dan contoh soal uji kompetensi.