Embed presentation
Downloaded 41 times


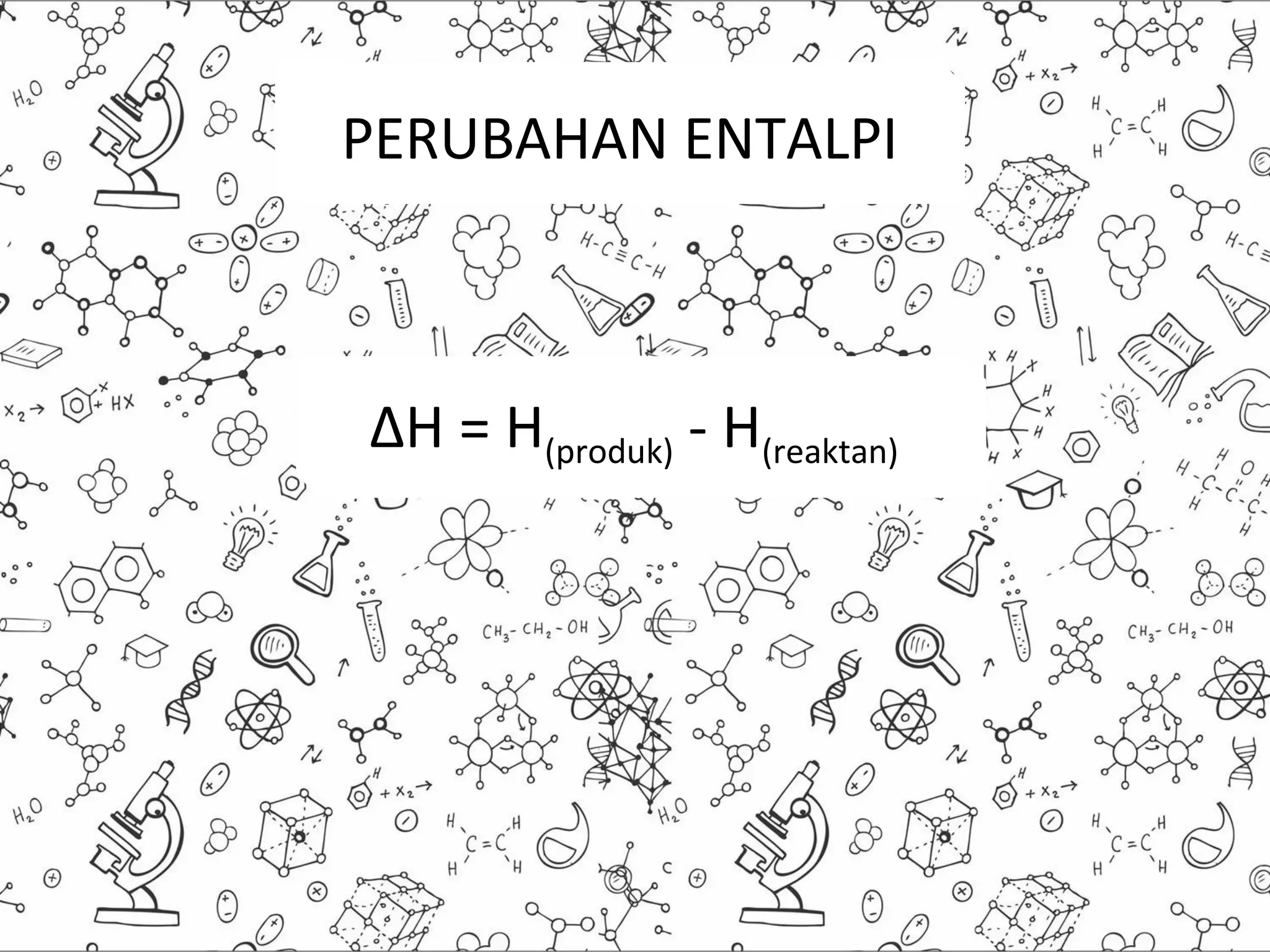







Dokumen ini membahas tentang perubahan entalpi standar dan aplikasinya. Perubahan entalpi standar adalah perubahan energi pada suatu sistem yang terjadi pada kondisi suhu dan tekanan standar, yaitu 25°C dan 1 atm. Perubahan entalpi pembentukan standar adalah perubahan energi kalor pada pembentukan 1 mol zat langsung dari unsur-unsurnya. Contoh perhitungan perubahan entalpi digunakan untuk menentukan









