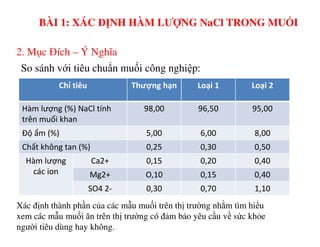
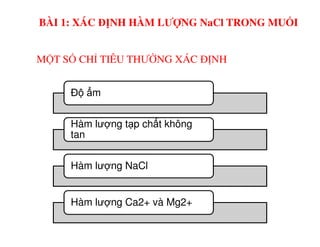
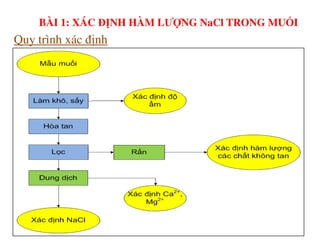
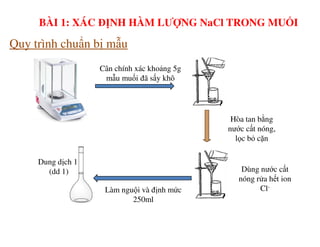
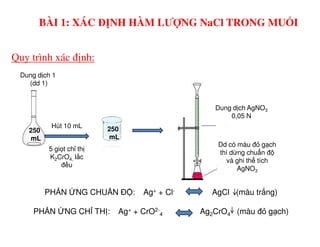
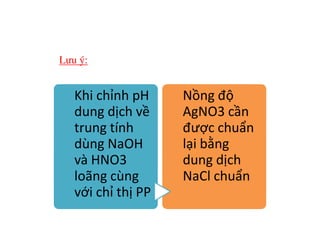
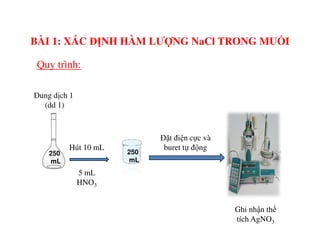
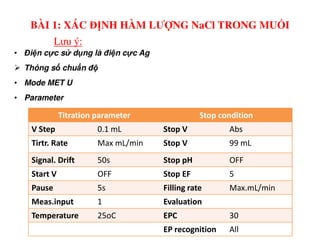
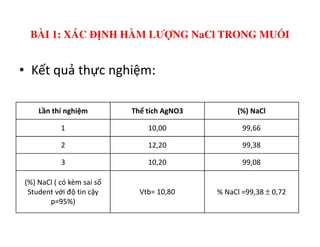
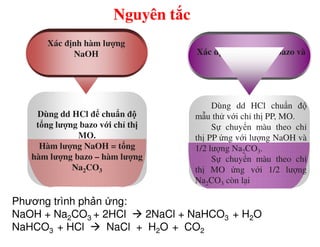
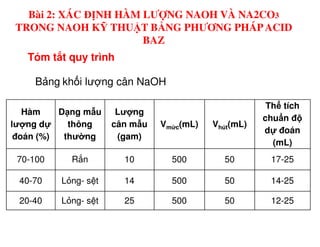
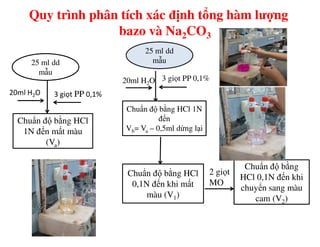
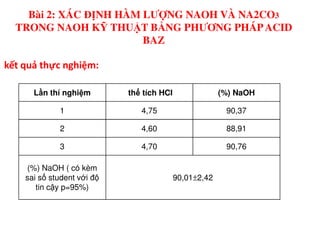
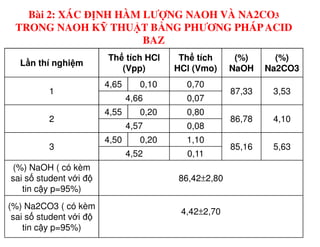
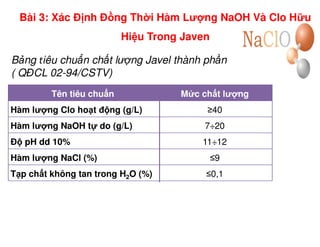
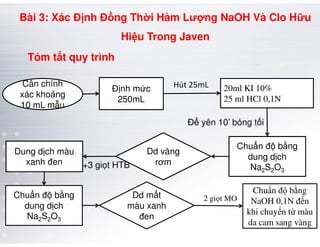
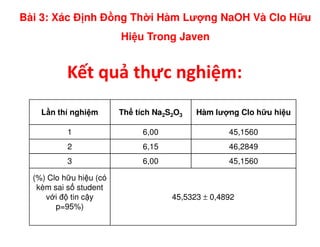
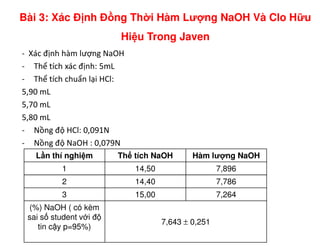
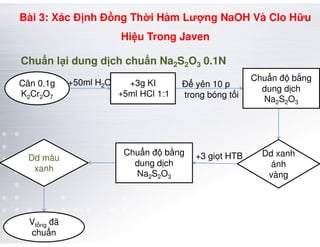
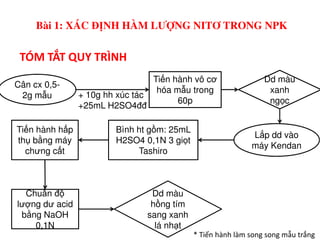
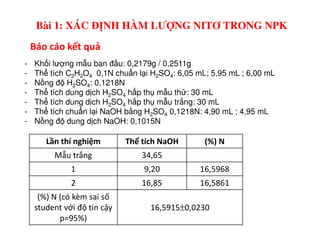
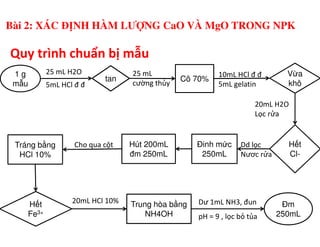
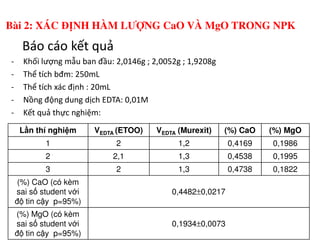
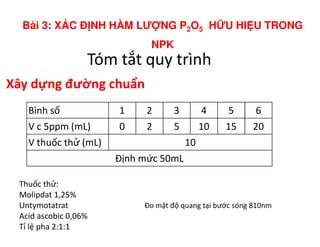
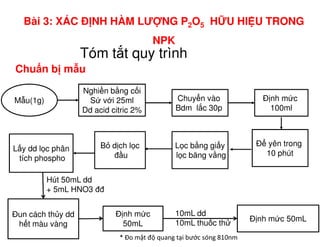
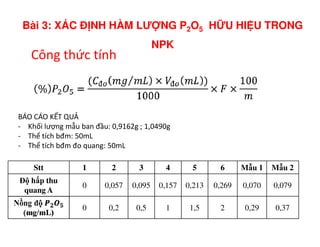
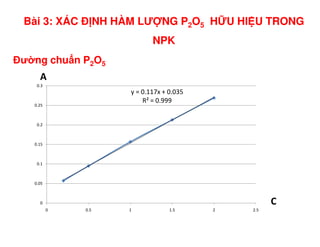
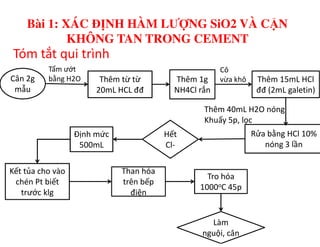
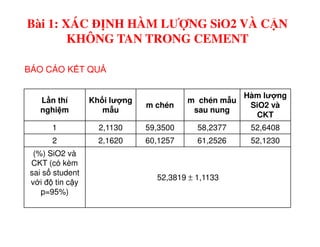
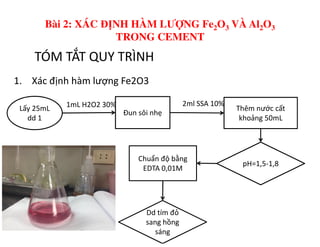
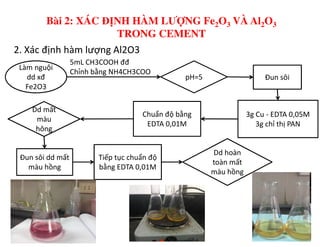
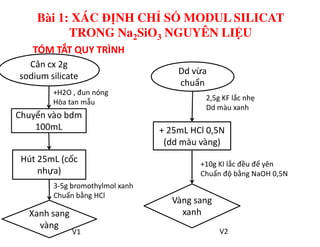
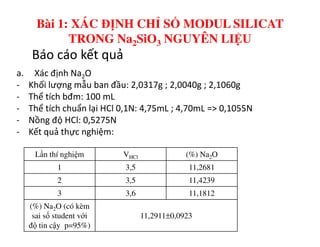
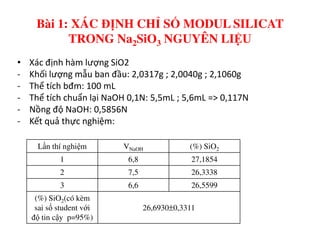
Tài liệu trình bày các phương pháp phân tích hàm lượng NaCl, NaOH và Na2CO3 trong muối và dung dịch Javel. Các phương pháp sử dụng bao gồm chuẩn độ điện thế và chuẩn độ acid-baz, nhằm đảm bảo các sản phẩm hóa chất giữ tiêu chuẩn an toàn cho sức khỏe người tiêu dùng. Kết quả thí nghiệm chỉ ra tỷ lệ hàm lượng hóa chất đạt yêu cầu trong mẫu kiểm nghiệm.