Nw i 3 elektriciteit
- 2. 3.1 Elektriciteit: geen natuurlijk fenomeen? Lading in beweging
- 3. 3.1 Elektriciteit: geen natuurlijk fenomeen? Elektriciteit = menselijke uitvinding zuil van Volta Φrsted & Ampère: elektromagnetisme
- 4. 3.1 Elektriciteit: geen natuurlijk fenomeen? Elektriciteit = menselijke uitvinding George S Ohm
- 5. 3.1 Elektriciteit: geen natuurlijk fenomeen? Voordelen van elektriciteit als energiebron
- 6. 3.2 Batterijen • Wat is een batterij? Een elektrische energiebron. Elektrische STROOM = geladen deeltjes die zich verplaatsen doorheen een geleidende draad. • Welke geladen deeltjes kunnen bewegen? Elektronen, die van de –pool naar de +pool gaan. Elektronen zijn enkel mobiel bij chemische reacties.
- 7. 3.2 Batterijen • 2 delen: de –kant levert e- en de +kant slorpt e-op. Hoe kan je dat chemisch verklaren? e- bestaan haast nooit apart, maar zijn betrokken in chemische reacties. Er moeten dus 2 reacties met e- -uitwisseling gebeuren. • Kennen jullie al een reactie waarbij elektronen worden uitgewisseld?? REDOX. • Waarvoor staat redox? REDuctie – OXidatie.
- 8. 3.2 Batterijen REDOX zoals je vorig jaar hebt gezien: eurocent in AgNO3 = kopermetaal in AgNO3 Cu lost op (onzichtbaar): oxidatie, want Cu(0) Cu2+ + 2e- (OG: 0 +II). Ag2+ slaat neer (zichtbaar): reductie want Ag2+ + 2e- Ag(0) (OG: +II 0).
- 9. 3.2 Batterijen • Wat is het grote verschil met de redox-koppels uit chemie (4e jaar)? Meestal gebeuren beide reacties in hetzelfde reactiemengsel, waardoor je enkel de reagentia ziet reageren tot nieuwe reactieproducten. Nu worden beide reacties uit elkaar getrokken, zodat je de e- kan dwingen zich te verplaatsen doorheen een geleidende draad: elektrische STROOM.
- 10. 3.2 Batterijen Elektrische stroomsterkte = hoeveelheid lading die zich verplaatst per seconde. (aantal e- dat zich verplaatst per seconde x Qe-) = I (intensiteit) wordt uitgedrukt in ampère (A) – ampèremeter 1 mA: lichte schok; > 30 mA: verkramping van spieren; >100 mA: hartritmestoornissen (fibrillatie); > 1 A: doorbranden van zachte weefsels.
- 11. 3.2 Batterijen Elektrische stroomsterkte 2 beveiligingen: 1. de aarding, om eventueel verliesstromen af te voeren naar de aarde; 2. de differentieelschakelaar, om het hoofd-circuit te onderbreken bij een verschil tussen inkomende en uitgaande stroom.
- 12. 3.2 Batterijen • Wanneer ondergaat een metaal een reductie? Of een oxidatie? • Of beter: wat bepaalt welke kant van de batterij de +pool is en welke kant de –pool? • En verder: wat is de drijvende kracht van een batterij?
- 13. 3.2 Batterijen Elektrische spanning = potentiaalverschil van het REDOX-koppel. (= hoeveelheid el. energie per lading) = U wordt uitgedrukt in volt (V, J/C) – voltmeter
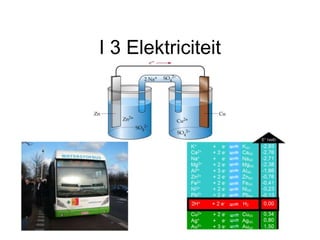
- 14. 3.2 Batterijen Elektrische spanning zuil van Volta (1800) en Daniell-cel (1836) gebruiken het redoxkoppel Cu – Zn (U = 1,10 V) elektroden in elektrolyten
- 15. 3.2 Batterijen + elektrode of kathode - elektrode of anode geleidende draad zoutbrug
- 16. 3.2 Batterijen Elektrische spanning Fruitklok: Daniell-cel met fruit als elektrolyten- en zoutbrugbron
- 17. 3.2 Batterijen Elektrische spanning
- 18. 3.2 Batterijen Elektrische spanning Eventueel staan er in 1 batterij verschillende cellen achter elkaar (in SERIE - dan tel je de verschillen op). Hoogspanning: 100000 V, netspanning: 220- 230 V (beiden wisselspanning). Spanning veranderen doen we via transformatoren of “adapters”.
- 19. 3.2 Batterijen Kenmerken van een batterij Zuur (~ accuzuur) of alkalisch (~ alkaline) Oplaadbaar of niet oplaadbaar Ladingscapaciteit = hoeveelheid lading (Ah) (hoe minder, hoe kleiner: C > AA > AAA) Vermogensdichtheid (Li- ion hoge stroom)
- 20. 3.3 Elektrische toestellen • Elektronen (e-) vloeien van + naar –pool via een geleidende, metalen draad. Waarom zijn metalen geleidend? Metaalbinding = vrije e-, die kunnen bewegen. • De spanning dwingt de e- tot bewegen. Waarom gaan ze zich niet allemaal onmiddellijk verplaatsen? Metaalbinding = ionenrooster van (+)metaalkernen met e--mantel: dit veroorzaakt hinder of weerstand.
- 21. 4.2 Weerstand Elektrische weerstand = hinder die een e--stroom ondervindt door de bouw van het geleidende metaal = R (re/ésistance) wordt uitgedrukt in ohm (Ω) Bij de meeste huishoudtoestellen is R < 100 Ω. Rmenselijk lichaam tussen 200000 Ω (zuiver en droog) en 200 Ω (vochtig of bezweet). Elektrische huisinstallatie :100 m koperen kabel, Rtotaal = ca. 1 Ω.
- 22. 4.2 Weerstand In elke gegeven situatie is er een vast verband tussen U, I en R: de wet van Ohm, U = R.I huishoudtoestellen (R < 100 Ω) I > 2 A Rmenselijk lichaam : zuiver en droog I = ca. 1 mA vochtig of bezweet I = ca 1 A
- 23. 4.2 Weerstand • Algemeen ontstaansprincipe van straling door elektronen: - Stroom = (vrije) e- met Ekin door beweging. - Atoom-gebonden e- : ook energie (schillen). - Botsing = energieoverdracht gebonden e- ondergaat excitatie. terugval : foton (bepaalde frequentie) • Foton = warmte – rood – oranje – geel – groen – blauw – indigo – violet – UV (ook bij verhit metaal).
- 24. 4.2 Weerstand WARMTE-elementen Joule-effect De warmte is - het doel op zich (waterkoker, wasmachine, …) - of eerder een bijproduct (gloeilamp 5% licht en 95% warmte).
- 25. 4.2 Weerstand LAMPEN Gloeilamp • W-draad • 3000 K • Rendement: 5% licht. Om deze reden is de gloeilamp van de Europese markt gehaald.
- 26. 4.2 Weerstand LAMPEN Fluorescentie- (t(ube)l(uminescent)) /spaarlamp • edelgas en Hg • e- afgeschoten botsing excitatie: UV fluorescentie-poeder P kleur Rendement: 20-30%.
- 27. 4.2 Weerstand LAMPEN Merk op: zowel bij de gloeilamp als de spaarlamp moeten de elektronen van de stroom andere elektronen exciteren. Dit verlaagt het rendement zeer gevoelig!
- 28. 4.2 Weerstand LAMPEN L(ight)E(mitting)D(iode) • diode van 2 halfgeleiders met ertussen een vast △E 1 soort foton = 1 soort licht • Rendement: 50% monochroom, 5% wit licht.
- 29. 4.2 Weerstand FOTOVOLTAÏSCHE CELLEN Foto-elektrisch effect = stroom door licht
- 30. 4.2 Weerstand SENSOREN • R ~ omgevingsparameter. - NTC / PTC: afhankelijk van de temperatuur digitale thermometers; - LDR: afhankelijk van de lichtinval lichtmeters, lichtsensoren.
- 31. 4.2 Weerstand ELEKTROMOTOREN Eelek Erotatie (zie I-5 Magnetisme)
- 32. 3.4 Elektrische energie • U = hoeveelheid energie per lading. • I = aantal elektronen per seconde • △t = tijd, aantal seconden Elektrische energie = de energie van elk bewegend e- (spanning U) x aantal e- per seconde (I) x tijdsduur (△t) = U.I.△t wordt uitgedrukt in joule (J)
- 33. 3.4 Elektrische energie • Weerstand overwinnen =energie verliezen. • Wrijving veroorzaakt warmte: het joule-effect. (In de +pool zijn de e- hun elektrische energie kwijt en worden ze vastgezet in de oxidatie. Ze hebben niet meer de energie om te ontsnappen. • Andere energievormen: licht, beweging, … (zie later) △t varieert elke keer vermogen, de elektrische energie per seconde.
- 34. 3.4 Elektrische energie Elektrisch vermogen = de energie van elk bewegend e- (spanning U) x aantal e- per seconde (I) = U.I (= R.I² = U²/R) = P (power) wordt uitgedrukt in Watt (W, J/s) Toestel: nominale spanning en het nominaal vermogen. optimale functie + bijhorend vermogen R = U²/P.
- 35. 3.4 Elektrische energie vermogen weerstand elektrische wekker ca. 2 W ca. 25 kΩ hi-fi keten 30 - 80 W ca. 1 kΩ kleurentelevisie 80 - 150 W ca. 0,5 kΩ koelkast 150 - 300 W ca. 0,25 kΩ mixer 250 - 400 W ca. 150 Ω stofzuiger 250 - 1 200 W ca. 100 Ω klopboormachine 400 - 1 000 W ca. 80 Ω broodrooster 500 - 1 000 W ca. 75 Ω microgolven 600 - 1 500 W ca. 50 Ω elektrische radiator 500 - 2 000 W ca. 50 Ω frituurketel 1 500 - 2 000 W ca. 30 Ω wasmachine 3 000 - 4 500 W ca. 15 Ω elektrisch fornuis ca.10 000 W ca. 15 Ω (op 380 V!)
- 36. 3.4 Elektrische energie • U = R.I geldt bij 1 weerstand. Wat als er meerdere weerstanden (toestellen) tegelijk werken? schakelingen (reeds gezien in TO of WW…) huisinstallatie = parallel (allemaal onafhankelijk)
- 37. 3.4 Elektrische energie • Voordeel: elke toestel kan werken op dezelfde nominale spanning. • Nadeel: hoe meer toestellen, hoe groter I
- 38. 3.4 Elektrische energie • Rkabels < 1 Ω zeer weinig energieverlies. • I ~ warmteproductie doorsmelten isolatie brand. • Beveiliging noodzakelijk! de zekering, een effectieve stroombegrenzer. - (vroeger) smeltzekeringen – Joule-effect. - (nu) automatische zekeringen (elektromagnetisch - zie I.4).
- 39. • Serie enkel bij spanningsdelers 10 x 500Ω 100V 3.4 Elektrische energie (volumeknop, dimmer) 500Ω
- 40. 3.4 Elektrische energie stand RI PPtot tot nuttig 10 500 Ω 200 mA 20,0 W 20,0 W 9 1000 Ω 100 mA 10,0 W 5,0 W 7 Ω mA W W 3 Ω mA W W 1 Ω mA W W 2000 50 5,0 1,25 4000 25 2,5 0,31 5000 20 2,0 0,20