PRAKTIKUM
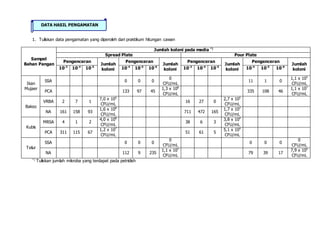
- 1. 1. Tuliskan data pengamatan yang diperoleh dari praktikum hitungan cawan Sampel Bahan Pangan Jumlah koloni pada media *) Spread Plate Pour Plate Pengenceran Jumlah koloni Pengenceran Jumlah koloni Pengenceran Jumlah koloni Pengenceran Jumlah koloni 10-3 10-4 10-5 10-4 10-5 10-6 10-3 10-4 10-5 10-4 10-5 10-6 Ikan Mujaer SSA 0 0 0 0 CFU/mL 11 1 0 1,1 x 105 CFU/mL PCA 133 97 45 1,3 x 108 CFU/mL 335 108 46 1,1 x 107 CFU/mL Bakso VRBA 2 7 1 7,0 x 105 CFU/mL 16 27 0 2,7 x 105 CFU/mL NA 161 158 93 1,6 x 108 CFU/mL 711 472 165 1,7 x 107 CFU/mL Kubis MRSA 4 1 2 4,0 x 108 CFU/mL 38 6 3 3,8 x 104 CFU/mL PCA 311 115 67 1,2 x 107 CFU/mL 51 61 5 5,1 x 104 CFU/mL Telur SSA 0 0 0 0 CFU/mL 0 0 0 0 CFU/mL NA 112 9 235 1,1 x 107 CFU/mL 79 39 17 7,9 x 105 CFU/mL *) Tuliskan jumlah mikroba yang terdapat pada petridish DATA HASIL PENGAMATAN
- 2. 2. Tuliskan tahapan dan cara perhitungan anda untuk mendapatkan jumlah koloni pada masing-masing sampel ! Tahapan Pada sampel ikan mujaer, langkah pertama yang harus dilakukan adalah dengan menggunakan cotton swab, mikroba pada permukaan sampel diambil dengan cara dioles dengan cotton swab tadi yang telah dibasahi dengan menggunakan pepton 9mL, ke kiri dan ke kanan masing-masing sebanyak tiga kali pada luas permukaan 4 cm2 . Kemudian batang pengoles tadi kita rendam dalam pepton yang sebelumnya digunakan untuk membasahi cotton swab tersebut. Setelah itu batang diputar-putar dan diperas pada dinding tabung untuk melepaskan mikroba yang melekat pada cotton swab. Dari suspensi tersebut kita mendapatkan pengenceran 10-1 . Kemudian dari pengenceran tersebut, kita buat pengenceran bertingkat sampai 10-6 .Penumbuhan mikroba dibuat dari pengenceran yang dikehendaki masing-masing 4 cawan untuk setiap pengeceran, yaitu 2 cawan diberi PCA dan dua lainnya diberi SSA dengen metode spread plate dan pour plate. Untuk inokulasi, kita gunakan 3 pengenceran tertinggi. Kemudian diinkubasi selama 2 hari pada suhu 30-32o C. Pada sampel bakso, kita potong terlebih dahulu bakso dengan pisau steril dengan berat sekitar 100 gr. Kemudian kita hancurkan dengan stomacher. Lalu kita ambil 1 ml dan kita masukkan ke dalam larutan pepton sebanyak 45 mL. Lalu kita homogenisasi dan kita mendapatkan pengenceran 10-1 . Lalu kita teruskan dengan pengenceran bertingkat sampai 10-6 . Setelah itu, sampel kita inokulasikan pada 4 cawan pada setiap pengenceran. 2 cawan untuk media VRBA, dan 2 lainnya untuk media NA dengan metode spread plate dan pour plate. Kita menggunakan pengenceran 10-3 ,10-4 dan 10-5 untuk penginokulasian. Lalu kita inkubasi diinkubasi selama 2 hari pada suhu 30-32o C. Selanjutnya untuk sampel kubis, tahapannya adalah yang pertama, kita potong kubis dengan gunting yang telah disterilisasi tanpa menyentuh kubis dengan tangan kita seluas 2 x 2,5 cm dan langsung masukkan ke dalam labu erlenmeyer yang berisi 25 mL larutan pepton. Setelah itu kita kocok sebanyak 25 kali dan kita dapat langsung menginokulasikannya ke dalam 4 cawan berbeda yang berisi MRSA dan PCA. Masing-masing 2 pada setiap pengenceran dengan metode pour plate dan spread plate. Sama seperti penginokulasian pada sampel bakso dan ikan mujaer. Pada penginokulasiannya, kita ambil pengenceran 10-3 ,10-4 dan 10-5 . Lalu langsung kita inkubasi selama 2 hari pada suhu 30-32o C. Yang terakhir, sampel telur, pertama-tama kita cuci telur dengan sabun sampai bersih dan kita lap dengan tissue. Selanjutnya, kita semprot dengan alkohol 70% dan kita keringkan dengan tissue agar bakteri kontaminan pada permukaan telur benar-benar hilang. Langkah kedua, kita lakukan fiksasi untuk mempermudah membuat lubang kecil pada bagian telur yang runcing. Lubang yang dibuat tidak boleh terlalu besar karena akan mempermudah mikroba kontaminan untuk masuk ke dalam sampel. Setelah terbentuk lubang, kita tuangkan isi telur ke dalam tabung erlenmeyer. Setelah itu kita kocok sampai rata. Kemudian kita ambil 1 mL sampel dengan mikropipet dan kita masukkan ke dalam 9ml larutan pepton dan kita homogenisasi sampai rata. Kemudian buat pengenceran selanjutnta yaitu 10-2 . Untuk penginokulasian, kita ambil 3 pengenceran tertinggi dan kita inokulasikan pada 4 cawan yang berisi 2 media SSA dan dua lainnya media NA dengan metode spread plate dan pour plate. Kemudian diinkubasi selama 2 hari pada suhu 30-32o C. Setelah 48 jam dilakukan pengamatan dengan menghitung jumlah koloni yang ada pada masing-masing agar dengan menghitung manual. Koloni yang
- 3. sudah dihitung ditanda agar tidak terhitung lagi. Jika ada koloni yang bersinggungan maka dihitung sebagai 1 koloni. Hasil pengamatan dapat dilihat pada bagian hasil pengamatan. Ada beberapa aturan dalam menghitung mikroba dengan SPC yaitu cawan yang dipilih untuk dihitung adalah cawan yang mengandung 30-300 koloni, koloni yang berkumpul dihitung 1 koloni, jika ada 2 memenuhi syarat 30-300 maka dihitung rata-ratanya, jika hasil rata-ratanya lebih dari 2 maka diambil pengenceran terendah, jika kurang dari 2 maka diambil nilai rata-ratanya. Jika tidak ada yang diantara 30-300 maka diambil nilai yang terdekat dengan 30-300. Dihitung dengan rumus jumlah koloni/ml = banyaknya koloni x 1/fp. Jumlah koloni/ml terdiri dari 2 angka, jika lebih maka dibulatkan. Perhitungan 1. Ikan Mujaer a. SSA (Spread Plate ) Jumlah koloni/mL = 0 b. SSA (Pour Plate) Jumlah koloni/mL = 11 x 1 10^−4 = 1,1 x 105 CFU/mL c. PCA (Spread Plate) Jumlah koloni/mL = 97 𝑥 1 10^−5 133 𝑥 1 10^−4 = 7,29 >2 Jumlah koloni/mL = 133 x 1 10^−5 x 10 = 1,33 x 108 CFU/mL d. PCA (Pour Plate) Jumlah koloni/mL = 46 𝑥 1 10^−6 108 𝑥 1 10^−5 = 4,26 >2 Jumlah koloni/mL = 108 x 1 10^−5 = 1,08 x 107 CFU/mL 2. Bakso a. VRBA (Spread Plate) Jumlah koloni/mL = 7 x 1 10^−4 x 10 = 7 x 105 CFU/mL b. VRBA (Pour Plate) Jumlah koloni/mL = 27 x 1 10^−4 = 2,7 x 105 CFU/mL c. NA (Spread Plate) Jumlah koloni/mL = 93 𝑥 1 10^−5 158 𝑥 1 10^−4 = 5,89 >2 Jumlah koloni/mL = 158 x 1 10^−5 x 10 = 1,58 x 108 CFU/mL d. NA (Pour Plate) Jumlah koloni/mL = 165 x 1 10^−5 = 1,65 x 107 CFU/mL
- 4. 3. Kubis a. MRSA (Spread Plate) Jumlah koloni/mL = 4 x 1 10^−4 x 10 = 4 x 105 CFU/mL b. MRSA (Pour Plate) Jumlah koloni/mL = 38 x 1 10^−3 = 3,8 x 104 CFU/mL c. PCA (Spread Plate) Jumlah koloni/mL = 67 𝑥 1 10^−5 115 𝑥 1 10^−4 = 5,83 >2 Jumlah koloni/mL = 115 x 1 10^−4 x 10 = 1,15 107 CFU/mL d. PCA (Pour Plate) Jumlah koloni /mL = 61 𝑥 1 10^−4 51 𝑥 1 10^−5 = 11,96 >2 Jumlah koloni/mL = 51 x 1 10^−5 = 5,1 x 106 CFU/mL 4. Telur a. SSA (Spread Plate) Jumlah koloni/mL = 0 b. SSA (Pour Plate) Jumlah koloni/mL = 0 c. NA (Spread Plate) Jumlah koloni/mL = 112 x 1 10^−4 x 10 = 1,12 x 107 CFU/mL d. NA (Pour Plate) Jumlah koloni/mL = 39 𝑥 1 10^−5 79 𝑥 1 10^−4 = 4,94 >2 Jumlah koloni/mL = 79 x 1 10^−4 = 7,9 x 105 CFU/mL 3. Bahaslah hasil yang anda peroleh pada masing-masing media untuk satu jenis sampel bahan pangan ! Dari praktikum yang telah dilakukan, hasilnya adalah pada sampel telur, terdapat 1,12 x 107 CFU/mL bakteri yang tumbuh pada media NA dengan metode spread plate. Pada pengenceran 10-4 terdapat 112 koloni, pada pengenceran 10-5 terdapat 9 koloni, dan pada pengenceran 10-6 terdapat 235 koloni yang tumbuh. Untuk metode pour plate pada media NA, ditemukan adanya 79 koloni yang tumbuh pada pengenceran 10-4, 39 koloni pada pengenceran 10-5 , dan 17 koloni pada pengenceran 10-6 . Hasilnya, jumlah koloni yang telah dihitung adalah sebanyak 7,9 x 105 CFU/mL. Namun, pada media SSA, tak satupun koloni tumbuh pada media tersebut. Baik yang diinokulasi dengan metode spread maupun pour plate. SSA digunakan untuk menyeleksi bakteri salmonella dan beberapa strains shigella dari specimen tinja (stool). Jadi dapat diasumsikan bahwa di dalam sampel telur yang
- 5. digunakan, tidak terkandung bakteri salmonella maupun beberapa strains shigella. Meskipun ada beberapa telur yang mungkin bisa terkontaminasi dengan bakteri tersebut karena kebersihan lingkungan kandang ayam yang kurang baik. Sedangkan Nutrient agar (NA) adalah medium umum untuk uji air dan produk dairy. Natrium agar (NA) juga digunakan untuk pertumbuhan mayoritas dari mikroorganisme yang tidak selektif, dalam artian mikroorganisme heterotrof. Biasanya bakteri coliform tumbuh dengan sangat baik dalam media ini. Contohnya seperti E.coli dan S.aureus. bisa jadi kedua bakteri ini terkandung dalam telur (Penn, 1991). 4. Tuliskan hasil pengamatan anda pada pengujian biru metilen pada produk susu. Sampel Waktu Reduksi (jam) Mutu susu Keterangan *Tidak dikerjakan 5. Bahaslah hasil yang anda peroleh pada pengujian biru metilen dari jenis sampel susu yang tersedia. *Tidak dikerjakan 6. Apa kesimpulan yang dapat ditarik dari praktikum ini? (a). Hitungan Cawan Prinsip dari Hitungan Cawan adalah menumbuhkan sel-sel mikroba yang masih hidup pada suatu atau beberapa media sehingga sel tersebut berkembang biak dan membentuk koloni-koloni yang dapat dilihat langsung dengan mata telanjang tanpa menggunakan mikroskop. Dari praktikum kali ini, kita mendapatkan hasil berupa jumlah koloni yang tumbuh pada suatu media yang didapatkan dari sampel tertentu. Pada sampel ikan mujaer,dengan metode spread plate pada media SSA, tidak ada koloni yang tumbuh. Sedangkan pada ada media PCA sebanyak 1,3 x 108 CFU/mL koloni tumbuh. Untuk media SSA selanjutnya dengan metode pour plate, didapatkan koloni dengan jumlah 1,1 x 105 CFU/mL. Sedangkan pada media PCA, didapatkan koloni sejumlah 1,1 x 107 CFU/mL. Pada sampel bakso, dengan metode spread plate pada media VRBA, kita dapatkan jumlah koloni sebanyak 7 x 105 CFU/mL dan pada media NA, koloni nya berjumlah 1,6 x 108 CFU/mL. Untuk metode pour plate pada media VRBA, kita dapatkan koloni sejumlah 2,7 x 105 CFU/mL dan pada media NA sebanyak 1,7 x 107 CFU/mL. Selanjutnya pada sampel kubis dengan metode spread plate pada media MRSA, kita mendapatkan koloni sebanyak 4,0 x 108 CFU/mL dan pada media PCA sebanyak 1,2 x 107 CFU/mL. Sedangkan pada metode pour plate dengan media MRSA, kita mendapatkan koloni sebanyak 3,8 x 104 CFU/mL dan pada media PCA sebanyak 5,1 x 104 CFU/mL. Untuk sampel terakhir, yaitu telur, dengan metode spread plate maupun pour plate pada media SSA tidak menunjukkan adanya koloni yang terbentuk. Sedangkan pada media NA, ada sebanyak 1,1 x 107 CFU/mL koloni dengan metode spread plate dan 7,9 x 105 CFU/mL koloni dengan metode pour plate. b). Pengujian Susu dengan metilen biru *Tidak dikerjakan
- 6. 1. Sebutkan kelebihan dan kekurangan dari metode pour plate dan spread plate. Kapan kita dapat menggunakan metode tersebut? Jelaskan alasan anda! 1. Spread Plate a. Kelebihan - Diperoleh koloni bakteri yang terpisah - Lebih mudah dilakukan - Jumlahnya koloninya mudah dihitung - Membutuhkan medium yang sedikit (hemat bahan) - Mikroorganisme yang dihasilkan tersebar merata pada permukaan media - Digunakan pada sampel dengan densitas sel tinggi serta merupakan mikrooragnisme aerob/anaerob fakultatif b. Kekurangannya - Waktu yang digunakan lebih lama - Mudah terkontaminasi - Tidak terlalu selektif sehingga hasil perhitungan kadang bias - Mikroba yang dapat dihitung hanya mikroba aerob - Sulit untuk mengetahui kontaminasi, harus melalui control - Kurang praktis karena harus membuat media padat terlebih 2. Pour Plate a. Kelebihan - Mudah dilakukan - Karena sampel dikocok homogen maka bakteri aerob maupun anaerob dimungkinkan dapat hidup - Mikroba yang tumbuh tersebar merata pada seluruh media agar baik di permukaan maupun di dalam agar - Dapat membedakan jenis koloni aerob, anaerob obligat dan anaerob fakultattif b. Kekurangan - Boros waktu dan bahan - Mudah terkontaminasi - Kontaminan sulit dibedakan karena semuanya dituang secara homogen Hal ini dapat dihindari dengan selalu bekerja dengan teknik aseptis - Mikroorganisme yang dihasilkan terkadang menumpuk sehingga sulit dihitung (Sutejo dkk, 1991). 2. Apa kelebihan perhitungan mikroba dengan metode hitungan cawan dibanding metode enumerasi langsung? Metode ini dianggap lebih baik, dan akurat bila dibandingkan dengan menghitung jumlah bakteri secara langsung menggunakan mikroskop karena metode hitungan cawan hanya menghitung jumlah bakteri yang hidup dan yang membentuk koloni saja, sedangkan yang mati tidak ikut terhitung. Selain itu metode ini lebih mudah dan praktis karena dapat dilihat langsung tanpa adanya alat bantu serta koloni yang terbentuk dapat digunakan untuk isolasi dan identifikasi mikroba karena koloni yang terbentuk mungkin berasal dari satu sel mikroba yang mempunyai penampakan spesifik (Sutejo dkk, 1991). PEMBAHASAN
- 7. 3. Mengapa yang digunakan dalam aturan SPC hanya koloni yang berjumlah 30-300 saja? Hal ini ditujukan untuk meminimalisir kemungkinan-kemungkinan kesalahan dalam proses analisa, terutama statistical error. Kisaran 30-300 koloni ini dijadikan titik tumpu dalam menentukan semua faktor yang dapat mempengaruhi hasil akhir, seperti berapa ukiuran sampel yang harus dianalisa dan metode apakah yang cocok untuk sampel tersebut. Disarankan sebelum menghitung atau menganalisa yang sebenarnya, dilakukan perkiraan (analisa pendahuluan) terlebih dahulu dengan mencoba memplatingnya pada ukuran sampel atau pengenceran yang berbeda-beda sehingga koloni yang dihitung sesuai atau termasuk dalam range tersebut. Ketentuannya, apabila sel terhitung dibawah 30, maka sampel yang dipakai terlalu encer hingga koloni yang terbentuk hanya sedikit. Sedangkan apabila sel yang terhitung lebih dari 300, itu menandakan bahwa sampel yang dipakai terlalu pekat hingga banyak bakteri tumbuh. Selain itu, bisa juga karena sampel kurang homogen, sehingga banyak bakteri tumbuh bertumpuk (Volk & Wheeler, 1993) 4. Apakah yang dimaksud dengan ”TNTC atau TBUD” pada pengamatan hitungan cawan? Dan mengapa hal tersebut bisa terjadi? Jelaskan! TNTC adalah singkatan dari Too Numerous To Count, sedangkan TBUD adalah singkatan dari Tidak Bisa Untuk Dihitung. Ini adalah kondisi dimana koloni yang terbentuk pada media terlalu banyak sampai tidak memungkinkan untuk dihitung. Jumlah koloni telah melewati batas penghitungan 30-300. Hal ini dapat terjadi karena faktor pengencerannya masih rendah sehingga konsentrasi bakteri di dalam suspensi masih banyak. Bisa juga karena penyebaran yang kurang merata sehingga membuat bakteri tumbuh secara bertumpuk dan susah dihitung. Hal ini dapat diatasi dengan membuat pengenceran yang lebih tinggi lagi dan lebih memperhatikan homogenisasi di setiap penginokulasian. Namun hal ini bisa juga terjadi karena adanya kontaminan yang masuk ke dalam media dan ikut berproses. Karena itu, para praktikan harus lebih memperhatikan penggunaan teknik aseptis di setiap penginokulasian (Barazandeh, 2008). 5. Berikut ini data hasil plating dari sampel kefir de carrota pada media MRSA. Hitung jumlah koloni berdasarkan metode SPC! Sampel Ke- Jumlah koloni Pada Pengenceran 10-4 10-5 10-6 1 TBUD 305 89 2 TBUD 248 82 3 189 52 21 4 TBUD TBUD 23 5 18 7 0 Hitung berapa jumlah koloni per mL nya berdasarkan aturan SPC. Tuliskan tahapan penghitungan anda! 1. Sampel ke-1 Jumlah koloni/mL = 89 x 1 10^−6 = 8,9 x 107 CFU/mL
- 8. 2. Sampel ke-2 Jumlah koloni/mL = 82 𝑥 1 10^−6 248 𝑥 1 10^−5 = 3,30 >2 Jumlah koloni/mL = 248 x 1 10^−5 = 2,5 x 107 CFU/mL 3. Sampel ke-3 Jumlah koloni/mL = 52 𝑥 1 10^−5 189 𝑥 1 10^−4 = 2,75 >2 Jumlah koloni/mL = 189 x 1 10^−4 = 1,9 x 106 CFU/mL 4. Sampel ke-4 Jumlah koloni/mL = 23 x 1 10^−6 = 2,3 x 107 CFU/mL 5. Sampel ke-5 Jumlah koloni/mL = 18 x 1 10^−4 = 1,8 x 105 CFU/mL Tahapan perhitungan : cawan yang dipilih untuk dihitung adalah cawan yang mengandung 30-300 koloni koloni yang berkumpul dihitung 1 koloni jika ada 2 memenuhi syarat 30-300 maka dihitung rata-ratanya, jika hasil rata- ratanya lebih dari 2 maka diambil pengenceran terendah, jika kurang dari 2 maka diambil nilai rata-ratanya. Jika tidak ada yang diantara 30-300 maka diambil nilai yang terdekat dengan 30-300 Dihitung dengan rumus jumlah koloni/ml = banyaknya koloni x 1/fp Jumlah koloni/ml terdiri dari 2 angka, jika lebih maka dibulatkan (Hilker,2009). 6. Mengapa pada analisis hitungan cawan satuan yang digunakan CFU/ml bukan sel per ml? Jelaskan alasan anda! Karena pada hitungan cawan, kita hanya menghitung sel bakteri yang hidup saja yang membentuk koloni pada media. Apabila kita menggunakan satuan jumlah sel/ml, itu berarti kita harus menghitung seluruh sel yang ada dalam cawan. Tidak hanya yang hidup saja, yang matipun juga ikut terhitung. Selain itu, dalam hitungan cawan, tujuan kita adalah menghitung koloni. Sedangkan apabila kita menggunakan satuan sel/ml, kita pun tidak mengetahui secara pasti berapa jumlah sel dalam setiap koloni yang terbentuk. Jadi kita tidak bisa menggunakan satuan sel/mL. Itulah tujuannya kita menggunakan CFU/mL, karena kita ingin menghitung sel yang membentuk koloni yang tampak saja (Irianto, 2006). 7. Bagaimana preparasi sampel untuk menghitung jumlah koloni pada permukaan agar? Langkah pertama kita siapkan terlebih dahulu cotton swab yang steril yang telah dicelupkan pada pepton. Kemudian kita oleskan pada sampel di beberapa bagian berbeda. Setelah itu kita celupkan cotton swab yang telah dicelupkan dalam sampel pada
- 9. larutan pepton 9ml, diulangi sebanyak 3 kali pengulangan. Setelah itu kita homogenisasi dengan vortex. Setelah itu, kita ambil 1 mL sampel dan langsung menginokulasikannya ke dalam cawan yang berisi media dengan metode spread plate dengan menggunakan spreader. Kemudian kita inkubasi selama 2 hari pada suhu 30-32o C lalu kita dapat langsung mengamati koloni yang tumbuh pada permukaan media (Garg, 2010). 8. Bagaimana preparasi sampel untuk menghitung jumlah koloni total/keseluruhan pada sampel makanan padat? Pertama, kita potong terlebih dahulu sampel padat yang akan kita gunakan dengan menggunakan pisau steril. Kemudian kita masukkan ke dalam plastik dan kita hancurkan dengan stomacher. Setelah itu kita ambil sampel yang telah dihancurkan sebanyak 1 ml dan kita campurkan ke dalam larutan pengencer pepton 9ml. Kemudian kita homogenisasi dengan menggunakan vortex. Nah, kita dapatkan pengenceran 10-1 . Lakukan pengulangan sampai mendapatkan tingkat pengenceran yang diinginkan. Kemudian kita ambil 1 mL sampel dan kita inokulasikan pada cawan yang berisi media. Kita inkubasi selama 2 hari dengan suhu 30-32o C. Setelah itu, kita dapat menghitung koloni yang tumbuh pada media dengan sampel makanan padat (Garg, 2010). 9. Faktor-faktor apa saja yang dapat mempengaruhi hasil penghitungan koloni pada metode hitungan cawan, hingga diperoleh hasil TNTC/TBUD atau koloni tidak muncul? 1. Faktor Pengenceran Pengenceran sangat penting karena apabila sampel kita terlalu encer, maka koloni yang terbentuk hanya sedikit saja bahkan menghasilkan TFTC(Too Few To Count). Dan apabila sampel kita terlalu pekat, jumlah koloni yang dihasilkan bisa menjadi sangat banyak bahkan sampai tidak bisa dihitung atau menghasilkan TNTC/TBUDtadi. 2. Kontaminasi Kita harus lebih memperhatikan teknik aseptis dan menggunakannya pada setiap kali penginokulasian. Karena apabila ada kontaminan yang masuk, kontaminan tersebut dapat tumbuh bersama kultur yang ingin kita tumbuhkan. Dan apabila kontaminan yang ada terlalu banyak, mereka dapat merusak perhitungan kita karena koloni yang terbentuk jadi menghasilkan TNTC/TBUD. 3. Pemerataan Sampel Sampel yang kita inokulasikan harus merata pada setiap media. Karena apabila tidak, koloni yang tumbuh bisa bertumpuk-tumpuk dan akan menyulitkan kita dalam menghitung serta menyulitkan kita dalam mendapatkan data yang akurat. Koloni yang bertumpuk-tumpuk akan menyebabkan TNTC/TBUD juga karena jumlahnya yang terlalu banyak (Waluyo, 2005). 10. Perhatikan data plating produk susu berikut ini! Pengenceran Jumlah Koloni pada Petri 1 Petri 2 Petri 3 10-1 TNTC TNTC TNTC 10-2 630 645 591 10-3 TNTC TNTC TNTC
- 10. 10-4 5 5 8 Hitunglah total mikroorganisme pada sampel susu tersebut (dalam CFU/ml)! Jelaskan modifikasi prosedur yang dapat anda lakukan untuk memperoleh hitungan cawan yang akurat! 1. Petri 1 Jumlah koloni/mL = 630 x 1 10^−2 = 6,3 x 104 CFU/mL 2. Petri 1 Jumlah koloni/mL = 645 x 1 10^−2 = 6,5 x 104 CFU/mL 3. Petri 1 Jumlah koloni/mL = 591 x 1 10^−2 = 5,9 x 104 CFU/mL Tidak ada cara untuk mengantisipasinya karena pada pengenceran 10-3 telah terjadi kontaminasi. Tidak mungkin pada pengenceran 10-2 masih dapat dihitung, sedangkan pada pengenceran selanjutnya tidak dapat terhitung. Pasti ada kontaminan yang telah masuk ke dalamnya. Jadi kita memakai pengenceran yang masih belum terkontaminasi yaitu pada pengenceran 10-2 . 11. Mengapa pada metode hitungan cawan digunakan media agar? Mengapa dilakukan teknik pengenceran sebelum dilakukan metode plating? Metode penghitungan cawan menggunakan media agar karena apabila koloni tumbuh pada media agar akan lebih mudah mengamatinya. Berbeda apabila kita menggunakan media broth. Pada media broth kita akan lebih sulit dalam menghitung koloni karena bentuknya adalah cair. Apabila bentuknya padat seperti agar, maka akan lebih mudah menghitungnya. Selain itu karena media agar juga cocok tidak hanya untuk bakteri aerob, tp juga anaerob karena sampel yang kita gunakan juga diasumsikan ada yang besifat anaerob. Sehingga dengan menggunakan media agar, pertumbuhannya tidak terhambat. Pentingnya melakukan pengenceran pada metode plating adalah untuk mengantisipasi munculnya TNTC/TBUD dan juga TFTC. Karena pabila pengenceran yang kita lakukan terlalu tinggi, maka koloni yang terbentuk hanya sedikit. Sedangkan apabila pengenceran yang kita lakukan terlalu rendah, maka kecenderungan menghasilkan TNTC/TBUD akan lebih besar. Koloni yang terbentuk cenderung tumbuh bertumpuk-tumpuk juga sampai tak bisa dihitung (Hadioetomo, 1993). 12. Mengapa suhu inkubasi yang digunakan pada kisaran suhu tertentu? Apa akibatnya jika suhu inkubasi dinaikkan atau diturunkan dari suhu semula? Karena suhu inkubasi tersebut sudah sangat sesuai dan dapat mendukung pertumbuhan mikroba dengan sangat baik. Suhu tersebut sangat disukai mikroba, oleh karena itu mereka jadi lebih cepat tumbuh dan berkembang biak. Apabila suhu tersebut dinaikkan, maka mikroba tersebut bisa mati atau terdenaturasi kecuali mikroba yang memang bersifat thermophilik. Dan apabila suhu tersebut diturunkan, mikroba tersebut juga akan mati karena tak tahan suhu dingin dan akan rusak karena enzimnya telah inaktif (Pleczar, 2006).
- 11. 13. Apa fungsi dari biru metilen dalam menentukan kualitas susu? Jelaskan dan tuliskan reaksi yang terjadi! *Tidak dikerjakan 14. Mengapa susu bisa menjadi cepat asam jika tidak segera disimpan dalam lemari pendingin? Berapa lama Jelaskan! *Tidak dikerjakan Komponen Penilaian LKP: Jenis Penilaian Nilai Maksimal Nilai yang diperoleh Pre lab 20 Diagram Alir 10 Data Hasil Pengamatan dan Pembahasan 70 TOTAL 100 Kompetensi Mahasiswa dan Nilai Maksimal Tiap Kompetensi No Kompetensi Nilai Maksimal Nilai yang diperoleh 1. Memahami peraturan yang terdapat dalam metode Standard Plate Count (SPC) 1 2. Mampu melakukan pemupukan dalam hitungan cawan dengan cara pour plate secara aseptis dan benar 1 3. Mampu melakukan pemupukan dalam hitungan cawan dengan cara spread plate secara aseptis dan benar 1 4. Mampu menghitung dan menentukan nilai SPC dari masing-masing cawan 1 5. Mampu melakukan interpretasi data SPC dari tiap sampel yang dianalisis 1 TOTAL 5 Kompetensi Mahasiswa dan Nilai Maksimal Tiap Kompetensi No Kompetensi Nilai Maksimal Nilai yang diperoleh 1. Mampu melakukan uji kualitas susu dengan metode reduktase metilen biru secara aseptis dan benar 3 2. Mampu menentukan kualitas susu berdasarkan hasil uji reduktase metilen biru 2 TOTAL 5
- 12. DAFTAR PUSTAKA Barazandeh, N. 2008. Microbiology Titles. Jerman : Springer-Verlag Berlin Heidelberg Media. Budi, U. 2006. Dasar TernakPerah Buku Ajar. Medan : Departemen Peternakan FP USU. Fardiaz S. 1992. Mikrobiologi Pangan 1. Jakarta: Gramedia Pusaka Utama. Garg, N. 2010. Laboratory Manual of Food Microbiology. New Delhi : LK International Publishing House Pvt. Ltd. Hadioetomo RS. 1993. Mikrobiologi Dasar dalam Praktek : Teknik dan Prosedur Dasar dalam Praktikum. Jakarta: Gramedia Pusaka Utama. Heritage, J. 2000. Introductory Microbiology. UK : Cambrige University Press. Hilker, D. 2009. Standard Plate Counting. http://mccc.edu.com, diunduh pada tanggal 16 Maret 2014 pukul 23:44 WIB. Irianto,Koes .2006 . Mikrobiologi . Yrama Widya; Bandung. Penn, C. 1991. Handling Laboratory Microorganism. Open university: Milton Keynes. Pleczar, M.J.2006. Dasar Dasar Mikrobiologi. Jakarta : UI-Press. Sutejo, M. M., Kartasaputra., Sastroadmodjo. 1991. Mikrobiologi Dasar. Jakarta : Reika Cipta. Volk & Wheeler. 1993. Mikrobiologi Dasar, Jilid 1, Edisi kelima. Jakarta : Erlangga. Waluyo, L. 2005. Mikrobiologi Umum. Malang : MM Press.