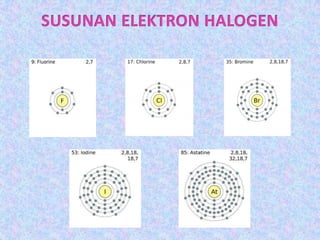
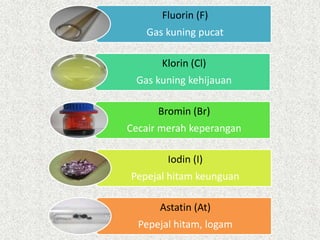
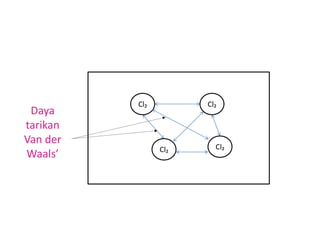
Dokumen ini menerangkan mengenai kumpulan 17 dalam jadual berkala, dikenali sebagai halogen, yang terdiri daripada elemen bukan logam yang sangat reaktif. Ia juga menjelaskan sifat-sifat fizikal halogen seperti perubahan keadaan, ketumpatan, serta warna yang semakin gelap apabila menuruni kumpulan. Penambahan jisim molekul dan daya tarikan antara molekul juga dibincangkan, bersama dengan kesan terhadap takat lebur dan takat didih.