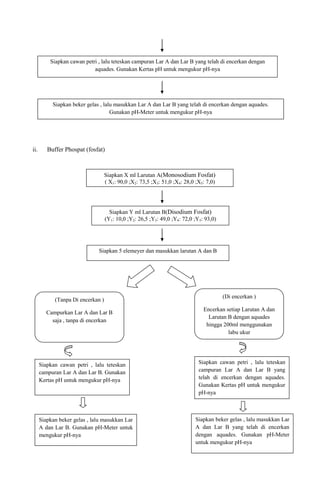
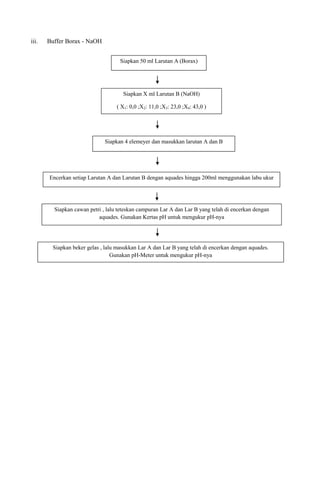
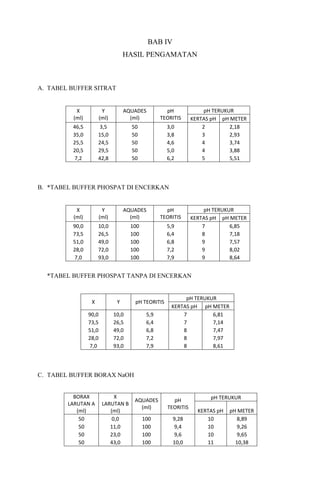
1. Percobaan membuat dan mengukur pH tiga jenis larutan buffer: sitrat, fosfat, dan borat-NaOH.
2. Hasilnya menunjukkan pH larutan buffer sitrat berkisar antara 2-5, fosfat antara 6-8, dan borat-NaOH antara 9-10.
3. pH terukur mendekati pH teoritis pada literatur, menunjukkan buffer berfungsi menstabilkan pH.