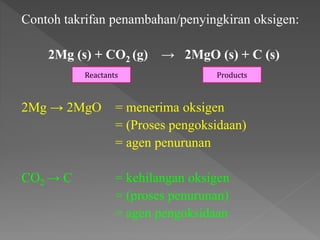
Dokumen ini membahas proses pengoksidaan dan penurunan dalam tindak balas kimia, serta konsep sel kimia dan elektrod. Proses ini melibatkan pertukaran elektron dan oksigen antara agen pengoksidaan dan agen penurunan. Selain itu, dijelaskan berbagai jenis sel kimia beserta penggunaannya dalam perangkat elektrik.