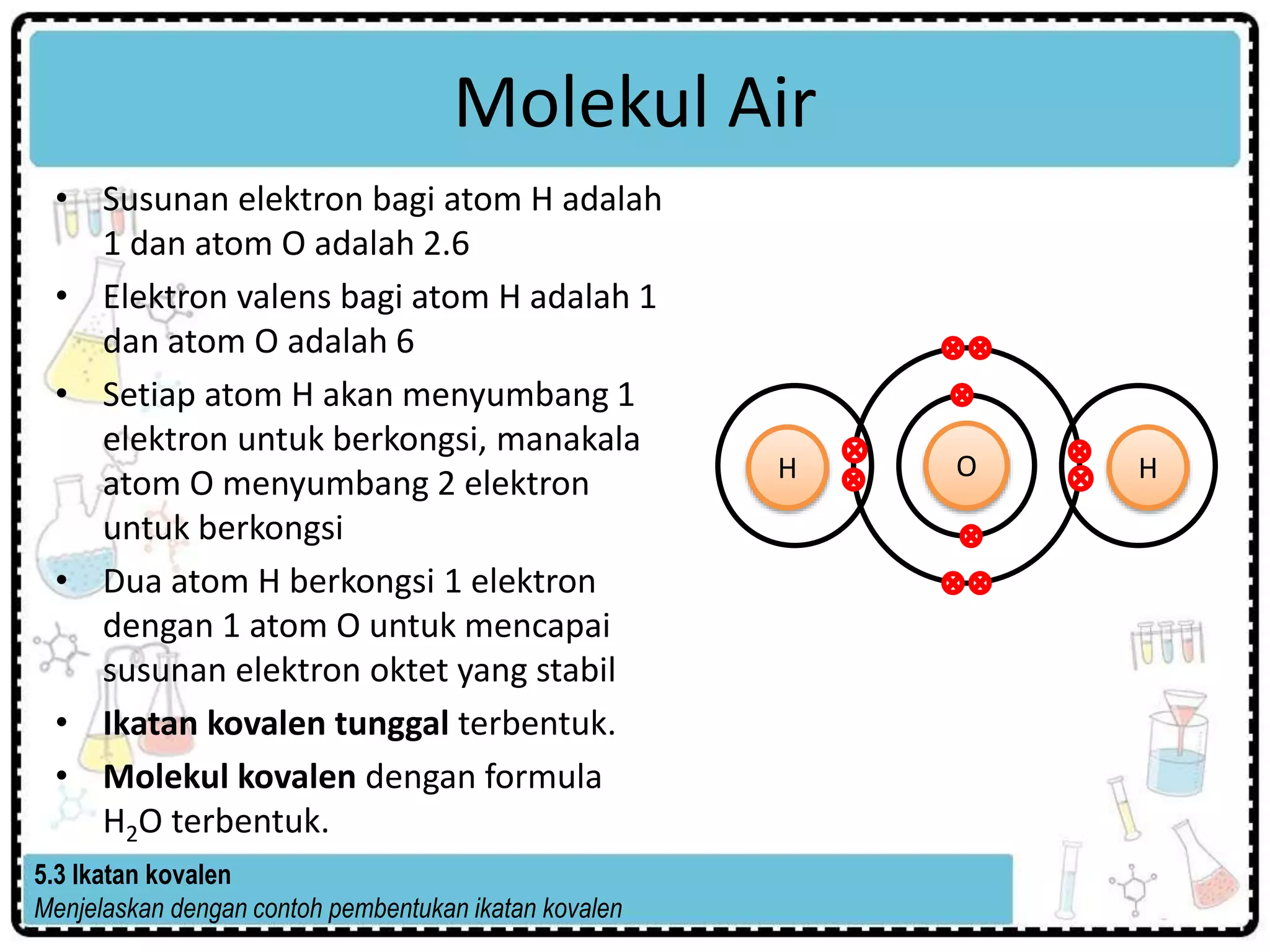
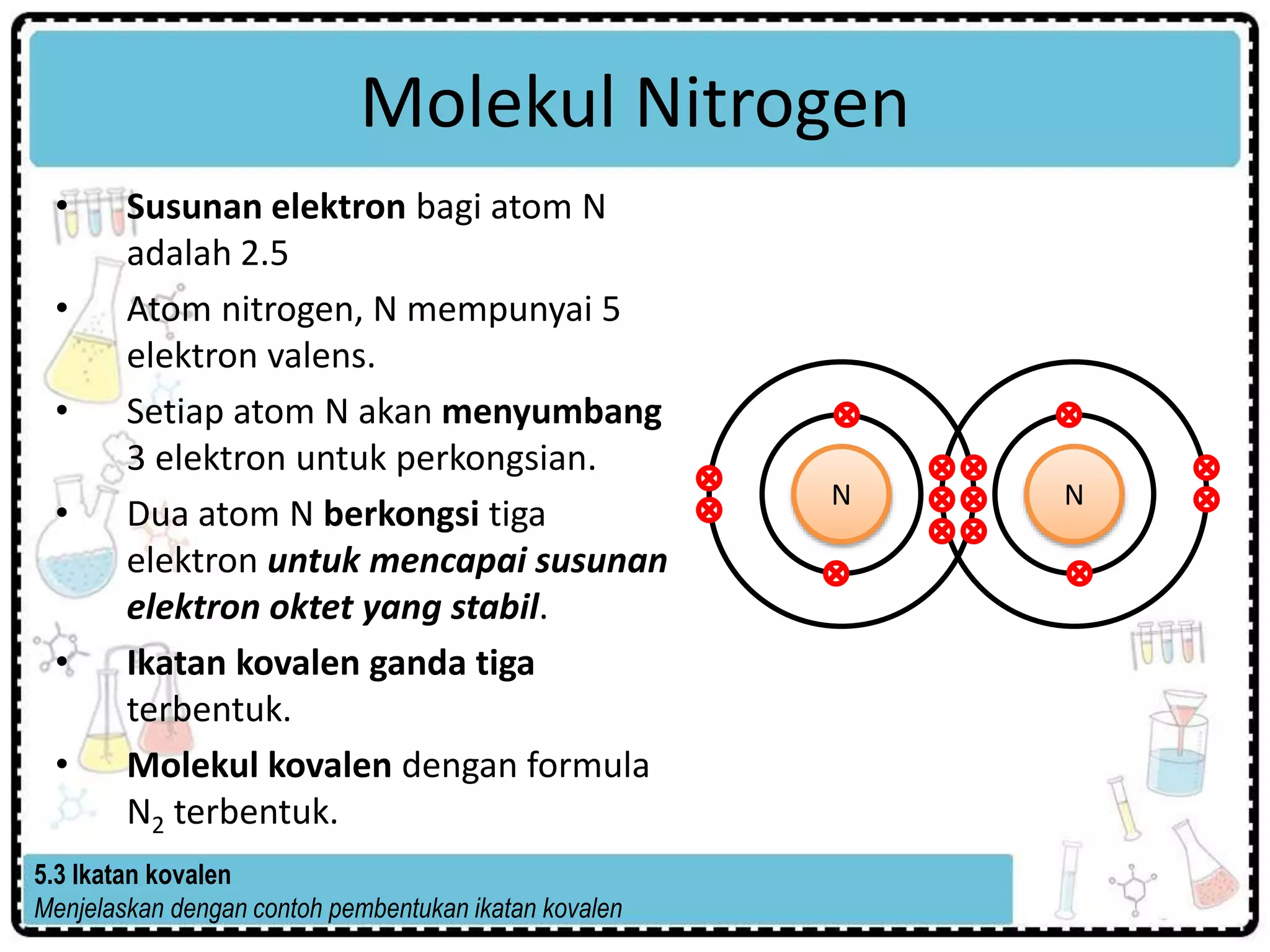
Dokumen tersebut membahas tentang ikatan kimia, termasuk pembentukan sebatian melalui ikatan ion dan ikatan kovalen. Ikatan ion terbentuk melalui pemindahan elektron antara logam dan non-logam, sementara ikatan kovalen terjadi ketika atom-atom berbagi elektron. Ikatan hidrogen juga dibahas sebagai daya tarikan antara hidrogen dan unsur-unsur elektronegatif.