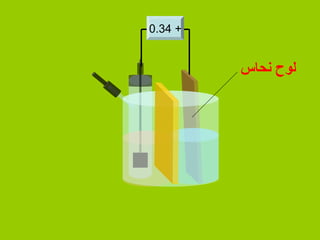
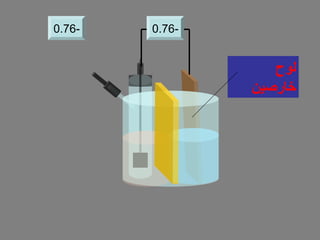
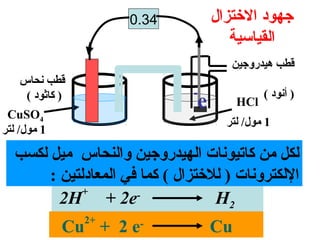
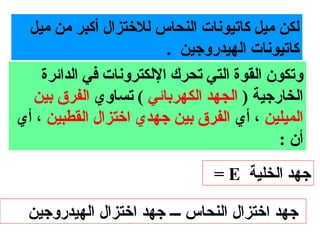
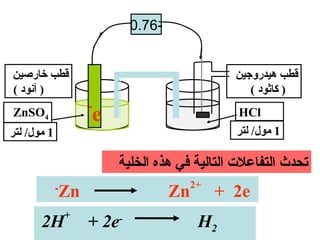
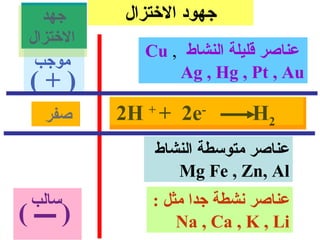
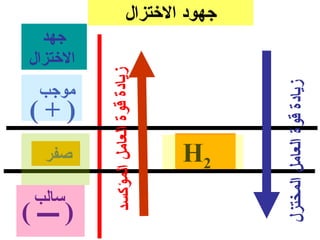
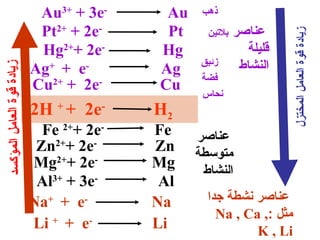
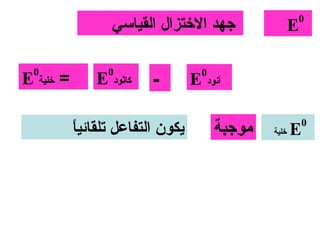
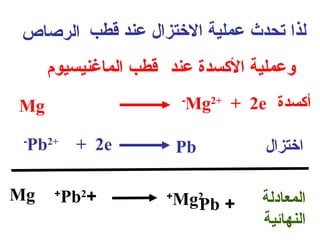
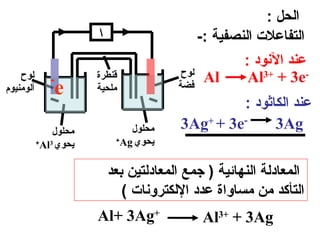
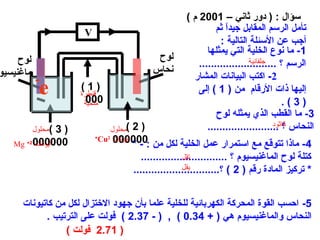
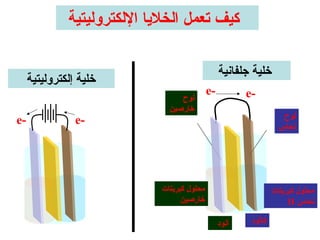
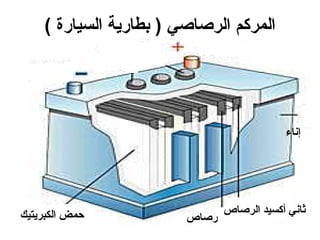
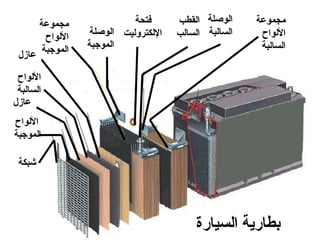
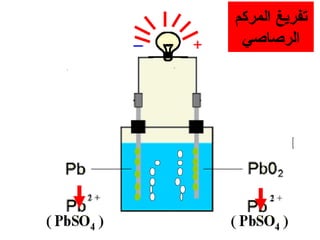
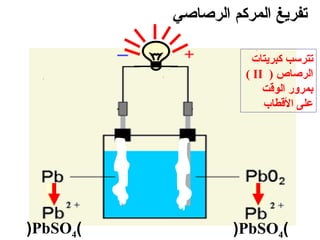
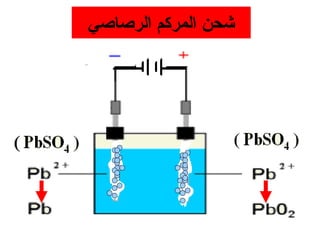
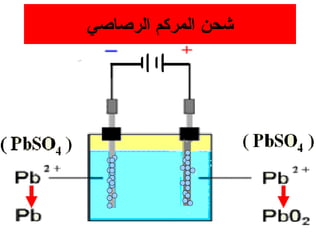
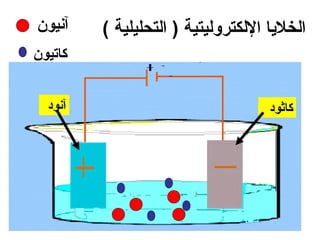
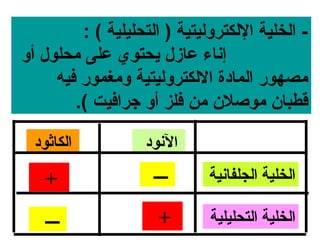
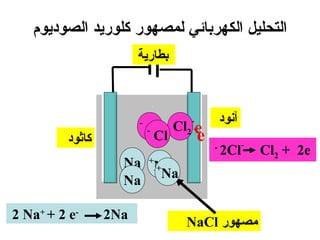
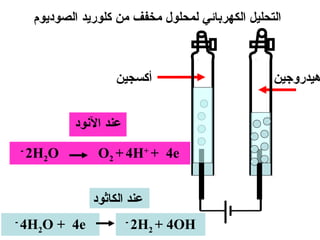
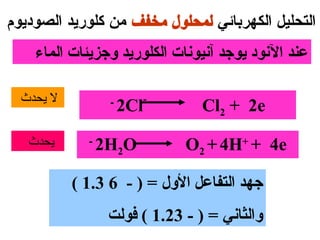
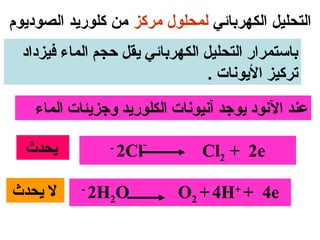
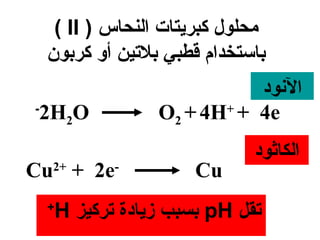
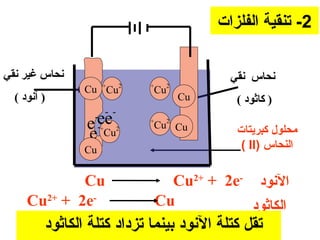
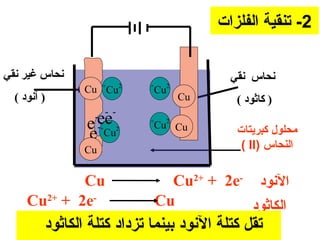
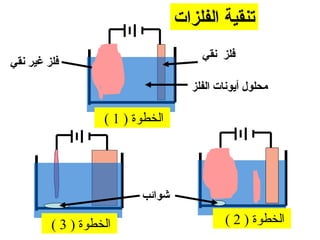
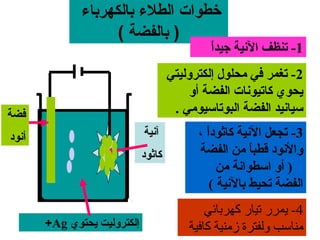
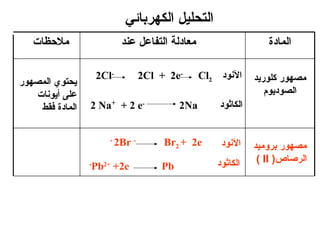
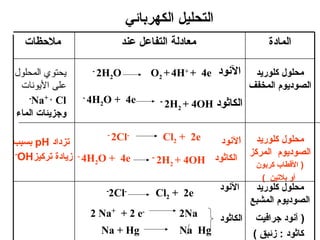
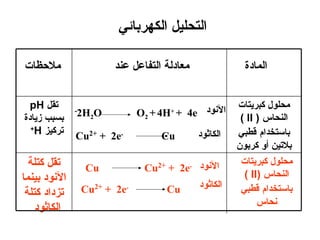
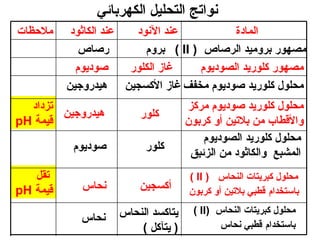
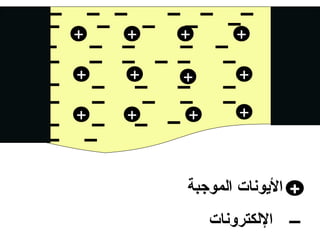
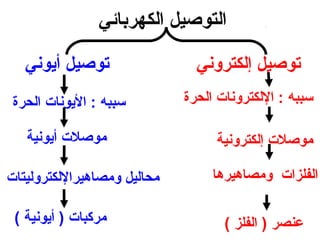
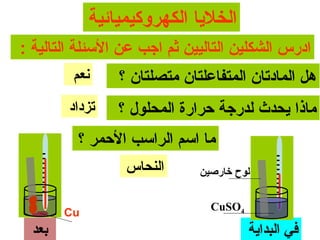
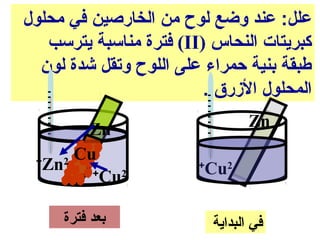
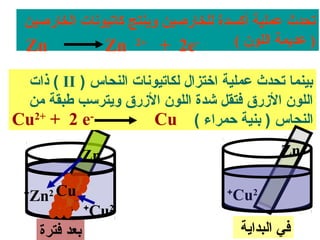
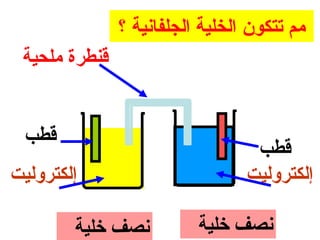
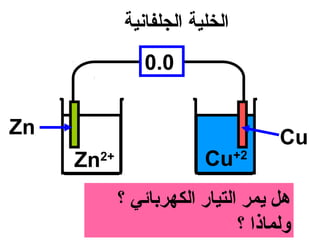
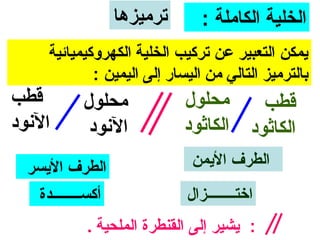
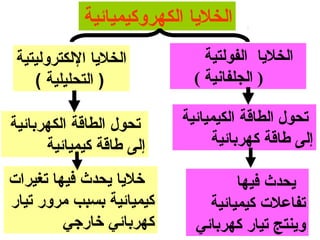
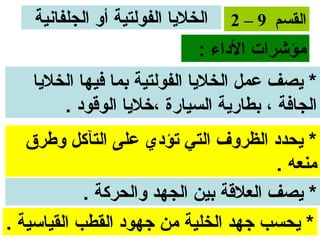
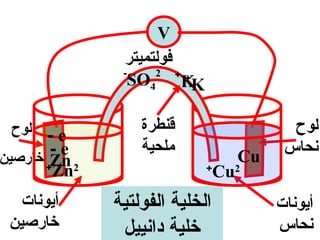
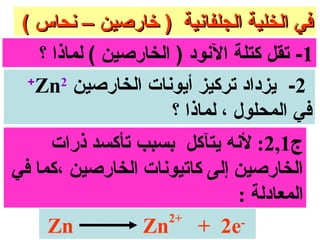
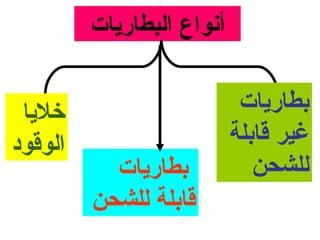
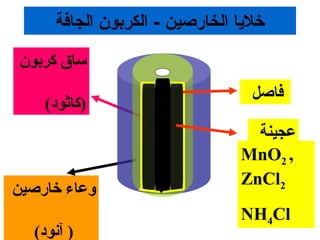
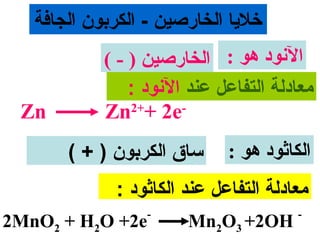
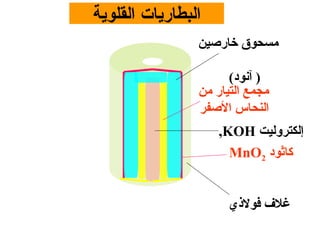
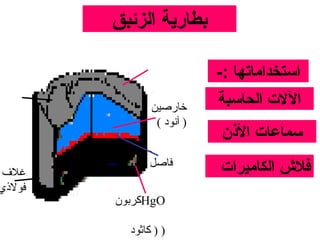
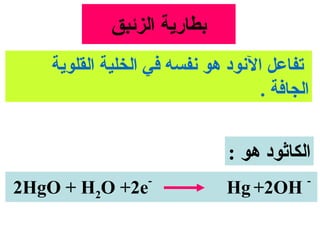
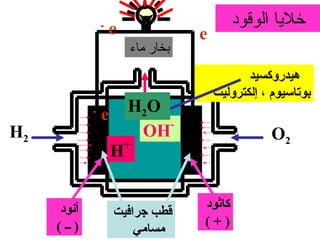
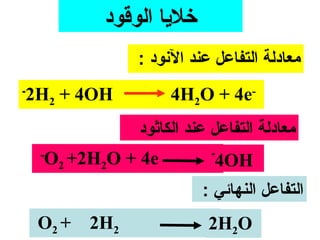
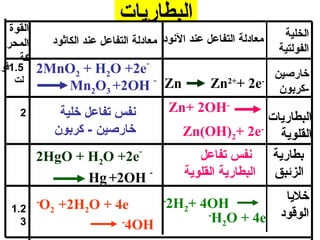
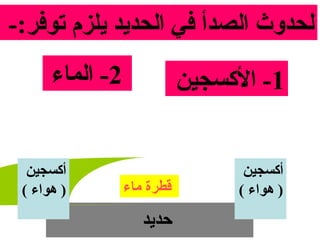
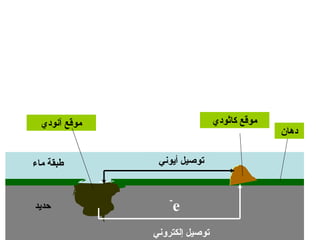
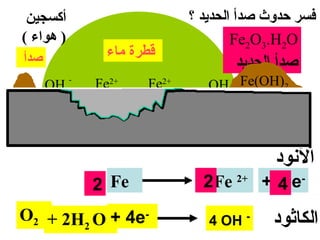
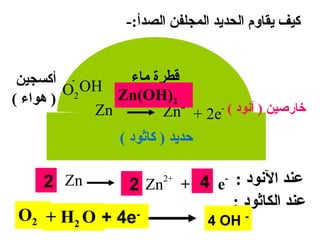
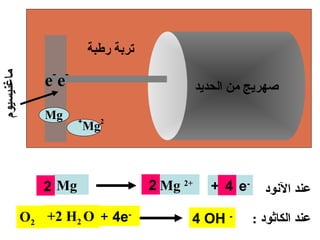
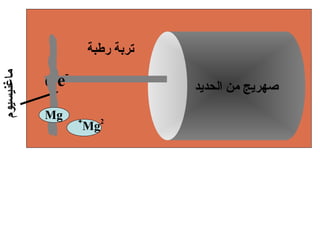
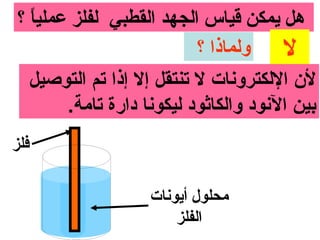
الفصل التاسع يتناول الكيمياء الكهربائية، عارضًا مكونات الخلايا الكهروكيميائية، وتفاعلات الأكسدة والاختزال. يتضمن شرحاً عن الخلايا الفولتية والجلفانية وطرق تحويل الطاقة الكيميائية إلى كهربائية، كما يشرح آلية تحرك الإلكترونات وتأثيرها على تركيز الأيونات في المحلول. يتطرق الفصل أيضًا لأنواع البطاريات، كالبطاريات القابلة للشحن والبطاريات الجافة وخلية الوقود، مقدماً آلية عمل كل نوع وظروفه.





























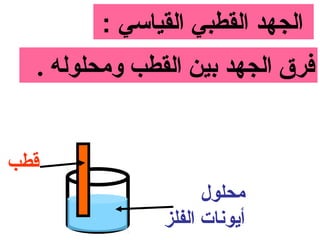

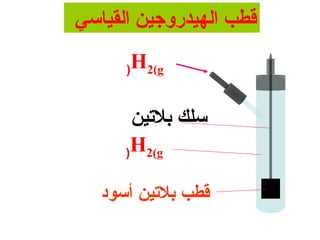
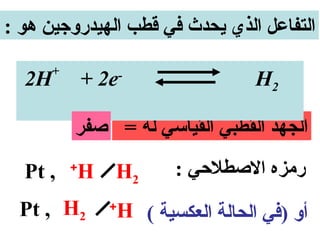
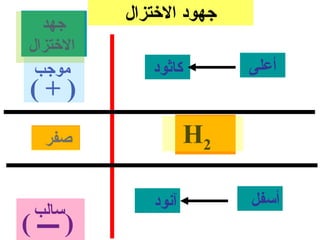
![رقطب الهيدروجين القياسي
الظروف القياسية :-
1- درجة الحرارة = 52 س
+
2- تركيز ] 1 = ] Hمول / لتر
3- ضغط الغاز = 1 ضغط جوي](https://image.slidesharecdn.com/random-130416165249-phpapp01/85/slide-66-320.jpg)