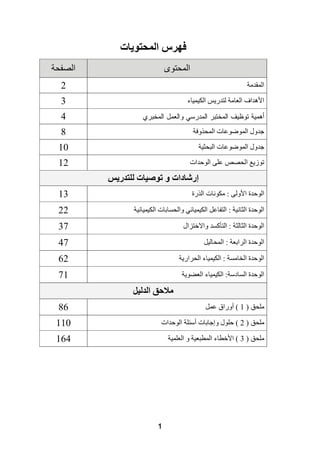
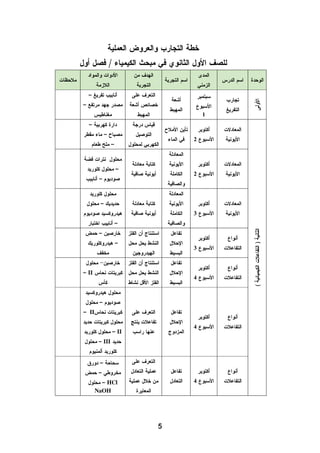
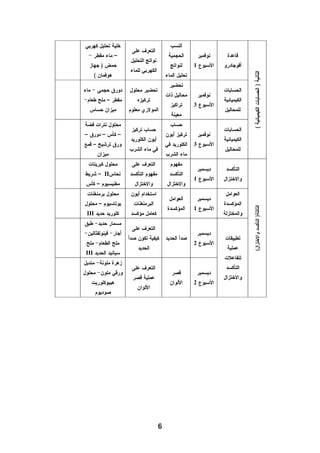
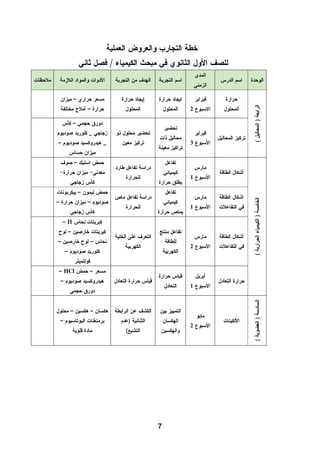
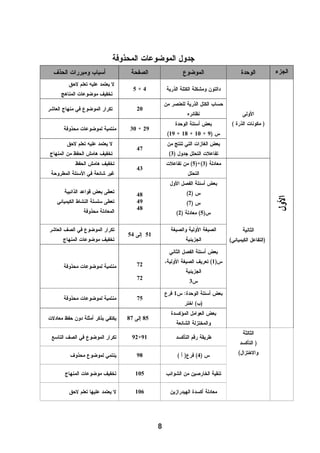
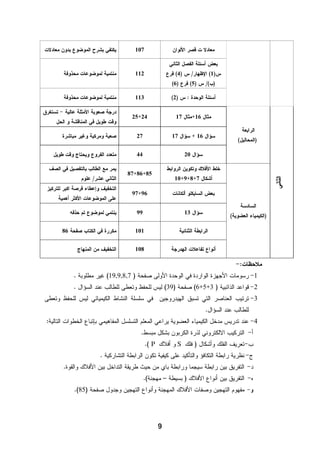
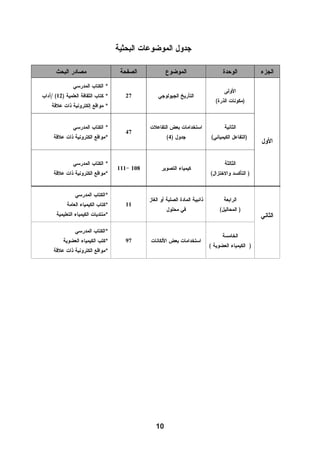
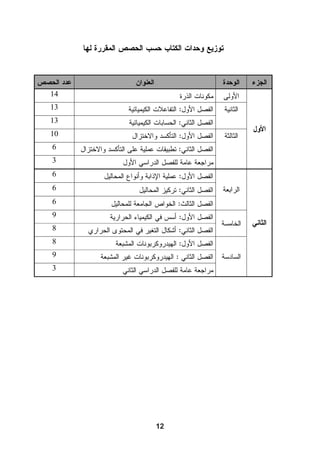
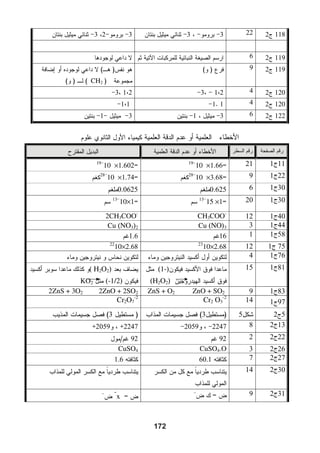
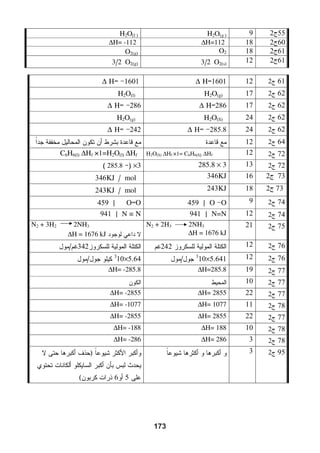
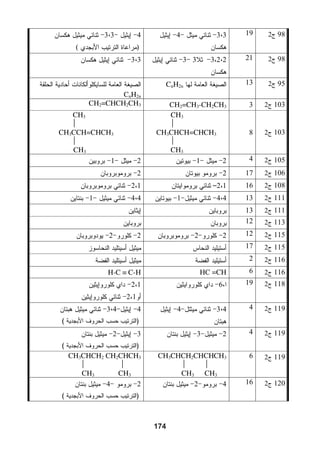
هذا دليل المعلم لمادة الكيمياء للصف الحادي عشر في فلسطين، يحتوي على الخطط الدراسية وأهداف التدريس والإرشادات اللازمة لتحسين جودة التعليم. تم إعداده بواسطة فريق من المعلمين والخبراء في المجال، ويهدف إلى تقديم الدعم للمعلمين في أداء مهامهم التعليمية. يوفر الدليل موارد ومواد تدريسية لتسهيل العملية التعليمية وتعزيز فعالية التدريس.