pembuatan larutan.docx
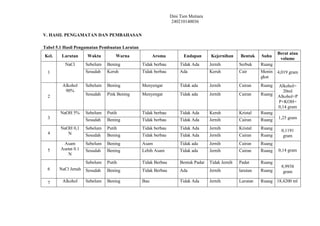
- 1. Dini Tien Mutiara 240210140036 V. HASIL PENGAMATAN DAN PEMBAHASAN Tabel 5.1 Hasil Pengamatan Pembuatan Larutan Kel. Larutan Waktu Warna Aroma Endapan Kejernihan Bentuk Suhu Berat atau volume 1 NaCl Sebelum Bening Tidak berbau Tidak Ada Jernih Serbuk Ruang 4,019 gram Sesudah Keruh Tidak berbau Ada Keruh Cair Menin gkat 2 Alkohol 90% Sebelum Bening Menyengat Tidak ada Jernih Cairan Ruang Alkohol= 20ml Alkohol+P P+KOH= 0,14 gram Sesudah Pink Bening Menyengat Tidak ada Jernih Cairan Ruang 3 NaOH 5% Sebelum Putih Tidak berbau Tidak Ada Keruh Kristal Ruang 1,25 gram Sesudah Bening Tidak berbau Tidak Ada Jernih Cairan Ruang 4 NaOH 0,1 N Sebelum Putih Tidak berbau Tidak Ada Jernih Kristal Ruang 0,1191 gram Sesudah Bening Tidak berbau Tidak Ada Jernih Cairan Ruang 5 Asam Asetat 0.1 N Sebelum Bening Asam Tidak ada Jernih Cairan Ruang 0,14 gram Sesudah Bening Lebih Asam Tidak ada Jernih Cairan Ruang 6 NaCl Jenuh Sebelum Putih Tidak Berbau Bentuk Padat Tidak Jernih Padat Ruang 8,9938 gram Sesudah Bening Tidak Berbau Ada Jernih larutan Ruang 7 Alkohol Sebelum Bening Bau Tidak Ada Jernih Larutan Ruang 18,4200 ml
- 2. Dini Tien Mutiara 240210140036 70% Sesudah Pink Berbayang Bau Tidak Ada Jernih Larutan Ruang PP 3 tetes 8 NaOH 10% Sebelum Putih Tidak Berbau Bentuk Padat Tidak Jernih Padat Ruang 2,5820 gram Sesudah Bening Tidak Berbau Tidak Ada Jernih Larutan Panas 9 NaOH 1 N Sebelum Putih Tidak Berbau Bentuk Padat Tidak Jernih Padat Ruang 1,0841 gram Sesudah Bening Tidak Berbau Tidak Ada Jernih Larutan Ruang 10 Asam Asetat 0,01N Sebelum Bening Bau Asam Tidak Ada Jernih Larutan Ruang 0,0572 ml Sesudah Bening Sedikit Bau Asam Tidak Ada Jernih Larutan Ruang
- 3. Dini Tien Mutiara 240210140036 Campuran homogen antara zat terlarut dengan pelarut yang komposisinya dapat berbeda dinamakan dengan larutan. Dua komponen dalam larutan yaitu zat pelarut dan zat terlarut. Zat pelarut atau solvent merupakann larutan yang ketika terbentuk keadaan fisiknya tidak berubah, sedangkan zat terlarut atau solute merupakan komponen yang dilarutkan dalam pelarut. Zat-zat pembentuk campuran homogen bercampur secara merata, tidak dapat dibedakan, serba sama, tidak memiliki bidang batas, dan mempunyai sifat yang sama pada seluruh bagian. Bahan untuk membuat reagen dapat berupa padat maupun cair, oleh karena itu tempat penyimpanannya perlu diperhatikan agar selalu dlam keadaan tertutup agar menghindari bahan tersebut berjamur atau terkontaminasi dengan kondisi ruangan disekitarnya sehingga dapat merubah sifat asli dari bahan itu sendiri. Selain itu pendidihan aquades bertujuan untuk menghilangkan oksigen yang ada pada aquades agar tidak bereaksi dengan masing-masing bahan yang akan dibuat larutan dengan konsentrasi yang diinginkan. Larutan yang akan dibuat pada praktikum kali ini adalah NaCl jenuh, Alkohol 95 % dan 70 %, NaOH 5 %, 10 %, 0, 1 N, dan 1 N, Asam Asetat 0, 1 N dan 0,01 N, dan KOH 0, 1 N. Perbedaan larutan jenuh dan larutan tidak jenuh : 1. Larutan tak jenuh yaitu larutan yang mengandung solute (zat terlarut) kurang dari yang diperlukan untuk membuat larutan jenuh. Atau dengan kata lain, larutan yang partikel- partikelnya tidak tepat habis bereaksi dengan pereaksi (masih bisa melarutkan zat). Larutan tak jenuh terjadi apabila bila hasil kali konsentrasi ion 2. Larutan jenuh yaitu suatu larutan yang mengandung sejumlah solute yang larut dan mengadakan kesetimbangan dengan solute padatnya. Atau dengan kata lain, larutan yang partikel- partikelnya tepat habis bereaksi dengan pereaksi (zat dengan konsentrasi maksimal). Larutan jenuh terjadi apabila bila hasil konsentrasi ion = Ksp berarti larutan tepat jenuh. Setiap praktikum komposisi yang dibutuhkan untuk mereaksikan suatu zat berbeda – beda tergantung pada kebutuhan praktikan. Dalam membuat suatu larutan yang diinginkan terlebih dahulu harus dihitung normalitas atau molaritas dari larutan tersebut agar diperoleh larutan yang sesuai dengan kebutuhan. Rumus perhitungan yang biasa digunakan untuk menghitung besar konsentrasi suatu reagen atau larutan adalah :
- 4. Dini Tien Mutiara 240210140036 V1.N1 = V2.N2 M = 𝑔 𝑀𝑟 𝑥 1000 v Tidak sedikit bahan yang berbahaya ketika bekerja didalam laboratorium, karena itu kita harus mengetahui standar keamanan dari bahan yang kita gunakan Material Safety Data Sheet (MSDS) yang pada umumnya dikenal dengan ‘Informasi Data Keamanan Bahan’ merupakan informasi mengenai cara pengendalian bahan kimia berbahaya (B3), bisa diartikan juga lembar keselamatan bahan. Informasi MSDS ini berisi tentang uraian umum bahan, sifat fisik, kimiawi, cara penggunaan, penyimpanan, hingga pengelolaan bahan buangan. Pada prinsipnya mengetahui dan menerapkan msds pada prinsipnya agar kita tetap terjaga kesehatan dan keselamatan pada waktu bekerja menggunakan bahan kimia. Selain itu fungsi MSDS adalah agar: 1. Mengetahui potensi bahan kimia 2. Menerapkan teknologi pengendalian dalam melindungi pekerja 3. Mengembangkan rencana pengelolaan bahan kimia di tempatg kerja 4. Merencanakan pelatihan pada kerja yang langsung kontak dengan B3 Dalam dunia kerja, baik di laboratorium maupun lapangan, komponen bahan kimia berada dalam : 1. Bahan baku (starting material) 2. Bahan produk utama 3. Bahan produk samping 4. Bahan untuk analisis 5. Bahan buangan Larutan NaCl Jenuh NaCl memiliki peran yang sangat penting dalam tubuh, diantaranya fungsi NaCl adalah berfungsi mengatur kontraksi otot, impuls saraf, tingkat air dan banyak hal lainnya. Setiap sel dalam tubuh memerlukannya dan lidah memiliki reseptor yang memberitahu otak saat garam telah memasuki mulut. Pembuatan NaCl jenuh adalah dengan menimbang terlebih dahulu NaCl yang berbentuk padatan sebanyak 20,00000017 gram setelah itu masukkan sedikit demi sedikit ke dalam aquades 25 ml sambil diaduk. Lakukan hingga NaCl tidak larut kemudian masukkan dalam labu ukur
- 5. Dini Tien Mutiara 240210140036 untuk dihomogenkan. Hitung berpa banyak naCl yang dibutuhkan dari 20,00000017 gram NaCl hingga terbentuk NaCl jenuh dengan ciri tidak larut. 20,00000017 – 15,981 = 4,01917 gram Perubahan – perubahan yang terjadi selama proses pembuatan NaCl jenuh adalah timbulnya endapan, berkurangnya kejernihan, dan suhu menjadi tinggi. Timbulnya endapan diakibatkan reaksi elektrolisis yang terjadi pada NaCl. Menurut literatur, reaksi elektrolisis garam NaCl menghasilkan endapan logam natrium di katoda dan gelembung gas Cl2 di anoda. Berkurangnya kejernihan adalah akibat larutnya NaCl dalam aquades. Pergerakan partikel zat menjadi lebih cepat dalam suhu tinggi dan dan kontak antara terlarut dengan pelarut menjadi lebih sering dan lebih efektif serta menyebabkan terlarut menjadi lebih mudah larut pada suhu tinggi. Padatan NaCl ketika dilarutkan dalam aquades akan terurai sempurna menjadi ion Na+ dan Cl- . Proses pelarutan zat terjadi akibat adanya tarikan antarpartikel komponen murni yang tergantikan dengan tarikan antara pelarut dan terlarut. Apabila pelarut dan terlarut sama-sama memiliki sifat polar maka akan terbentuk suatu struktur zat pelarut yang mengelilingi zat terlarut. Bila komponen terlarut ditambahkan terus- menerus ke dalam pelarut, pada suatu titik, komponen terlarut yang ditambahkan tidak akan dapat larut lagi. Ini berarti jumlah zat terlarut yang dapat larut dalam pelarut tersebut sudah maksimal. Zat terlarut NaCl dapat terurai sempurna menjadi ion-ion, maka dari itu NaCl termasuk dalam larutan elektrolit kuat. Proses pelarutan zat terjadi akibat adanya tarikan antarpartikel komponen murni yang tergantikan dengan tarikan antara pelarut dan terlarut. Apabila pelarut dan terlarut sama-sama memiliki sifat polar maka akan terbentuk suatu struktur zat pelarut yang mengelilingi zat terlarut. Bila komponen terlarut ditambahkan terus-menerus ke dalam pelarut, pada suatu titik, komponen terlarut yang ditambahkan tidak akan dapat larut lagi. Ini berarti jumlah zat terlarut yang dapat larut dalam pelarut tersebut sudah maksimal. Berdasakan data MSDS, sifat fisik dan kimia dari NaCl adalah berbentuk solid atau merupakan bubuk kristal padat, berbau sedikit, mempunyai cita rasa khas garam, memiliki berat molekul: 58,44 g / mol, berwarna putih, memiliki pH netral yaitu 7, titik didihnya yaitu 1413 ° C (2575,4 ° F), dan mempunyai titik leleh 801 ° C (1473,8 ° F). NaCl mudah larut dalam air dingin dan air panas. NaCl juga larut dalam gliserol dan
- 6. Dini Tien Mutiara 240210140036 ammonia. Tetapi NaCl sangat sedikit larut dalam alkohol dan tidak larut dalam Asam klorida. Larutan Alkohol 95 % dan 70 % Praktikum kali ini juga membuat larutan alkohol namun dalam konsentrasi yang berbeda yaitu alkohol 95 % dan alkohol 70 %. Alasan pembuatan alkohol 95% netral dan alkohol 70% netral tidak menggunakan alkohol 100% adalah karena tidak stabil dan tidak dapat disimpan dalam botol reagen karena alkohol memiliki sifat mudah menguap. Pembuatan larutan alkohol 95 % yaitu dengan menambahkan 5 tetes indicator phenolftalen pada alkohol 95 % kemudian diteteskan KOH 0,1 N 3 tetes kemudian aduk hingga berwarna pink. Pembuatan larutan alcohol mengguanakan KOH yang sebelumnya juga dibuat terlebih dahulu yaitu dengan masukkan KOH yang berbentuk padatan 0, 14 gram yang sebelumnya dilakukan perhitungan terlebih dahulu, kemuadian larutkan dalam aquades 25 ml. Untuk membuat larutan alkohol 70 % diperlukan perhitungan terlebih dahulu untuk membuat larutan alkohol 70 % dalam 50 ml : 70% 95% 𝑥 25 𝑚𝑙 = 18,42 ml Perhitungan diatas menunjukkan bahwa praktikan membutuhkan alcohol sebanyak 18,42 ml unt7k membuat larutan alcohol 70 % kemudian ditambahkan aquades 6,58 ml agar larutan menjadi 25 ml. Setelah itu teteskan 3 tetes indicator phenolftalen kemudian aduk hingga berwarna pink. Berdasarkan data MSDS, alkohol memiliki sifat fisik dan kimia antara lain yaitu berbentuk cairan, memiliki bau khas alkohol, mempunyai rasa terbakar dan tajam. tidak berwarna, memiliki pH netral, titik didih lebih dari 760 C (168,80 F), titik beku : - 113,840 C (-172,90 F), memiliki masa jenis : 0,789 – 0,806, tekanan uap : 5.7 kPa, densitas : 1,59 – 1,62 dan tingkat penguapan : 1,7 Solubilitas. Alkohol 95% larut dalam air dingin, air panas, methanol, dietil eter, dan aseton. Larutan NaOH Natrium hidroksida (NaOH) atau dikenal dengan larutan yang dpat menyebabkan noda kuning pada kain atau kertas merupakan jenis basa logam kaustik
- 7. Dini Tien Mutiara 240210140036 yang terbentuk dari oksida basa Natrium Oksida yang dilarutkan dalam air. Natrium hidroksida membentuk larutan alkalin yang kuat ketika dilarutkan ke dalam air. Natrium hidroksida murni berbentuk putih padat dan tersedia dalam bentuk pelet, serpihan, butiran ataupun larutan jenuh 50%. Bila dibiarkan di udara akan cepat menyerap karbondioksida dan bersifat lembab. NaOH juga sangat larut dalam air dan akan melepaskan panas ketika dilarutkan. Larutan NaOH yang dibuat dalam praktikum kali ini terdapat 4 macam yaitu naoh konsentrasi 5 % dengan 10 % dan naoh dengan normalitas 0,1 N dan 1 N. langkah pembuatannya yaitu dengan menimbang NaOH yang sebelumnya telah dihitung terlebih dahulu agar mengetahui berapa banyak NaOH yang dibutuhkan untuk membuat larutan tersebut. Setelah itu masukkan akuades sedikit demi sedikit, kemudian pindahkan ke dalam labu ukur 25 ml dan tambahkan akuades hingga batas labu ukur. Penggunaan labu ukur adalah untuk menghomogenkan larutan NaOH yang dibuat. Larutan NaOH baik yang padat maupun yang Kristal menghasilkan larutan yang keruh dan tidak jernih. Berdasarkan data dari MSDS, kelarutan NaOH mudah larut dalam air dan dalam etanol tetapi tidak larut dalam eter. Titik leleh 318°C serta titik didih 1390°C. Sifat kimia NaOH membentuk basa kuat bila dilarutkan dalam air. Senyawa ini sangat mudah terionisasi membentuk ion natrium dan hidroksida. NaOH juga termasuk jenis ikatan ionik kuat yang merupakan gabungan dari (Na+) + (OH-) sehingga selisih elektronegatifnya lebih dari 2 dan larutannya merupakan elektrolit kuat karena terionisasi sempurna pada air. Larutan Asam Asetat Asam Asetat adalah senyawa kimia dengan rumus molekul CH3COOH, berupa cairan jernih tidak berwarna, berbau tajam, dan berasa asam. Bahan kimia ini memiliki titik didih sekitar 117,9 C pada tekanan 1 atm, dan pada konsentrasi tinggi akan menimbulkan korosi pada berbagai jenis logam. Larutan asam asetat dalam air merupakan sebuah asam lemah, artinya hanya terdisosiasi sebagian menjadi ion H+ dan CH3COO- . Sifat-sifat kimia asam asetat dapat dilihat dari segi keasaman, dan dapat digunakan sebagai pelarut. Asam asesat bersifat asam dikarenakan Atom hidrogen (H) pada gugus karboksil (−COOH) dalam asam karboksilat dapat dilepaskan sebagai ion
- 8. Dini Tien Mutiara 240210140036 H+ (proton), sehingga memberikan sifat asam. Asam asetat adalah asam lemah monoprotik dengan nilai pKa=4.8. Basa konjugasinya adalah asetat (CH3COO− ). Asam asetat dapat digunakan sebagai pelarut protik hidrofilik (polar), mirip seperti air dan etanol. Asam asetat memiliki konstanta dielektrik yang sedang yaitu 6.2 sehingga dapat melarutkan baik senyawa polar seperti garam anorganik dan gula maupun senyawa non-polar seperti minyak dan unsur-unsur seperti sulfur dan iodin. Asam asetat bercampur dengan mudah dengan pelarut polar atau nonpolar lainnya seperti air, kloroform dan heksana. Sifat kelarutan dan kemudahan bercampur dari asam asetat ini membuatnya digunakan secara luas dalam industri kimia. Selan itu, Asam asetat bersifat korosif terhadap banyak logam seperti besi, magnesium, dan seng, membentuk gas hidrogen dan garam-garam asetat (disebut logam asetat). Pembuatan asam asetat 0, 1 N dan 0,01 N sebanyak 25 ml, yaitu pada pembuatan asam asetat 0,01 N dengan menambahkan 0,057 ml asam asetat glasial 100 % kemudian masukkan dalam labu ukur seperti pembuatan larutan NaOH sebelumnya yaitu labu ukur untuk menghomogenkan larutan asam asetat. Dalam larutan asam asetat tidak terdapat endapan dan larutannya jernih.
- 9. Dini Tien Mutiara 240210140036 VI. KESIMPULAN DAN SARAN 6. 1 Kesimpulan 1. Adanya endapan merupakan tanda bahwa larutan sudah jenuh. 2. Proses pengenceran melibatkan pencampuran suatu larutan pekat dengan pelarut tambahan untuk memberikan volume akhir yang lebih besar. 3. Tiap larutan mempunyai konsentrasi yang berbeda-beda, mempunyai fungsi dan peranan yang berbeda-beda pula. 4. Normalitas yang diinginkan dapat diperoleh dengan mencampurkan bahan- bahan tertentu dengan perbandingan yang tepat. 6.2 Saran 1. Pada saat melakukan prosedur pembuatan larutan, praktikan sudah dalam keadaan siap dan jangan bermain-main dalam pembuatannya. 2. Perlakuan yang berbeda-beda pada setiap pembuatan larutan harus dicermati, karena akan mempengaruhi hasil akhir.
- 10. Dini Tien Mutiara 240210140036 DAFTAR PUSTAKA Brady, James E. 1999. Kimia Universitas Asas & Struktur. Penerbit : Binarupa Aksara, Jakarta. HAM, Mulyono. 2006. Membuat Reagen Kimia di Laboratorium. Penerbit : Bumi Aksara, Jakarta Kusnandar, Feri. 2010. Kimia Pangan Komponen Makro. Penerbit : Dian Rakyat, Jakarta. Underwood, dkk. 2002. Analisis Kimia Kuntitatif. Edisi keenam. Penerjemah Iis Sopyan. Penerbit PT. Erlangga, Jakarta
- 11. Dini Tien Mutiara 240210140036 LAMPIRAN 1. Larutan NaCl jenuh Kelompok 6 : 25 gram NaCl – 16,0474 gram NaCl = 8,9526 gram Kelompok 1 : 25 gram NaCl – 20,984 gram NaCl = 4,016 gram 2. Alkohol a. Alkohol 95% Diukur 20 ml dan ditetesi PP serta KOH b. Alkohol 70% Pengenceran dari alkohol 95% : 95% × volume akuades = 70% × 25 ml akuades Volume akuades = 18,42 ml Kemudian ditetesi PP 3. Larutan NaOH a. NaOH 5% 5% × 25 ml akuades = 1,25 gram NaOH dan ditimbang 1,25 gram b. NaOH 10% 10% × 25 ml akuades = 2,5 gram NaOH dan ditimbang 2,5820 gram c. NaOH 0,1 N N = M × e N = M × 1 N = 𝑔𝑟𝑎𝑚 𝑀𝑟 × 1000 𝑚𝑙 0,1 = 𝑔𝑟𝑎𝑚 40 × 1000 25 gram = 0,1 gram dan ditimbang 0,1191 gram d. NaOH 1 N N = 𝑔𝑟𝑎𝑚 𝑀𝑟 × 1000 𝑚𝑙 1 = 𝑔𝑟𝑎𝑚 40 × 1000 25 gram = 1 gram dan ditimbang 1,0841 gram
- 12. Dini Tien Mutiara 240210140036 4. Larutan Asam Asetat a. Asam asetat 0,1 N N = % × 10 × 𝜌 𝑀𝑟 N = 100% × 10 × 1,05 60,05 N = 17,48 N V1 × N1 = V2 × N2 25 × 0,1 = V2 × 17,48 V2 = 0,14 ml dan diukur 0,14 ml b. Asam asetat 0,01 N N = % × 10 × 𝜌 𝑀𝑟 N = 100% × 10 × 1,05 60,05 N = 17,48 N V1 × N1 = V2 × N2 100 × 0,01 = V2 × 17,48 V2 = 0,0572 ml dan diukur 0,0572 ml