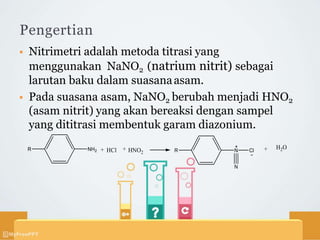
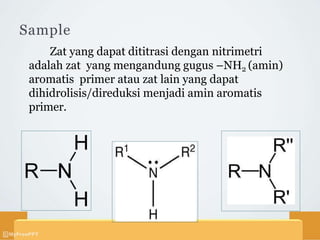
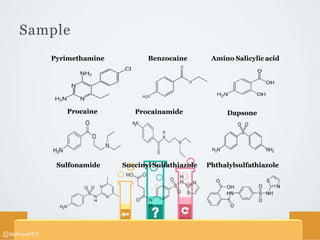
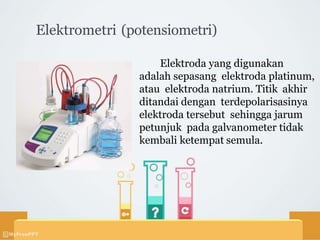
Titrasi nitrimetri menggunakan larutan natrium nitrit sebagai baku untuk mereaksikan sampel menjadi garam diazonium dalam suasana asam. Sampel yang dapat dititrasi meliputi zat yang mengandung amina aromatis primer atau dapat dihidrolisis menjadi amina sejenis. Titik akhir ditentukan secara visual menggunakan indikator dalam atau luar, atau secara elektrometri menggunakan elektroda.