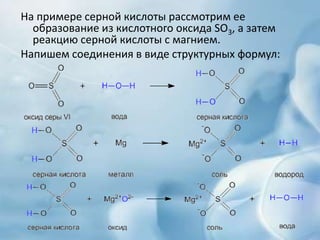
Документ описывает свойства и реакции кислот, включая их состав, нейтрализацию с основаниями и взаимодействие с металлами. Упоминаются различные типы кислот, их поведение с индикаторами и реакции с оксидами. Также рассматривается влияние силы кислоты на реакционные способности и выделение водорода.