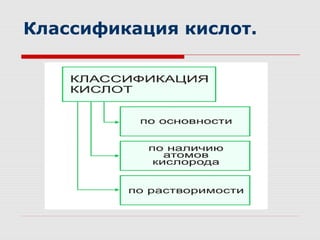
Документ представляет собой план урока по теме кислот, в котором изложены цели, этапы и задания для учеников, включая исследование свойств и применения различных кислот. Ученики изучают классификацию кислот, проводят эксперименты и знакомятся с правилами безопасности при работе с ними. Урок включает визуализацию информации и практические упражнения, направленные на закрепление материала.