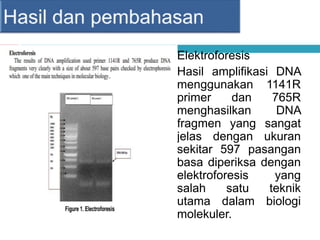
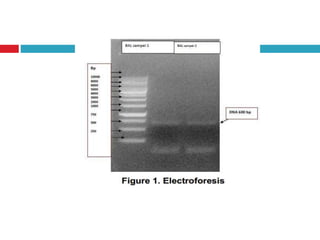
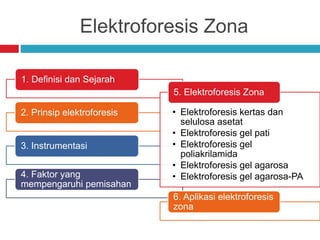
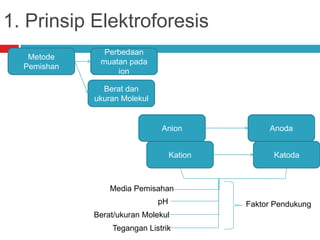
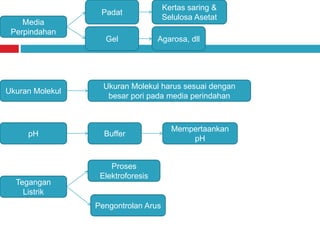
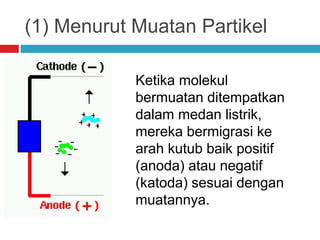
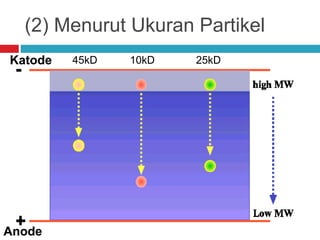
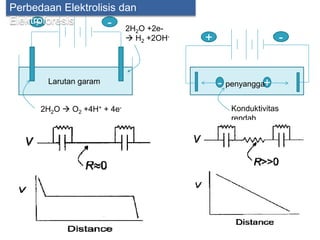
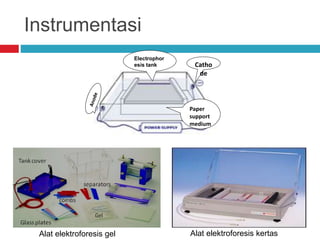
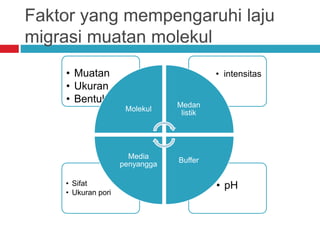
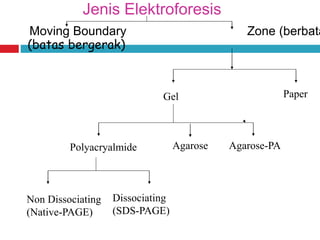
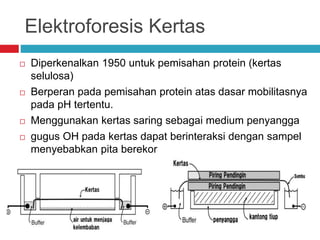
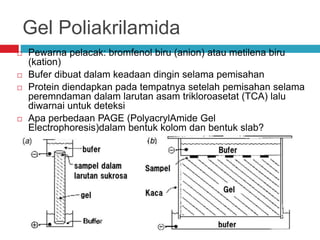
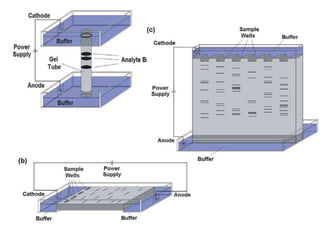
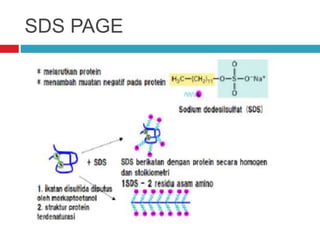
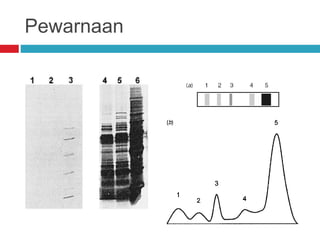
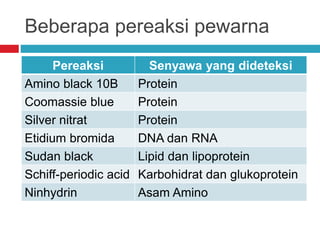
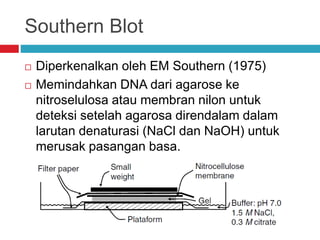
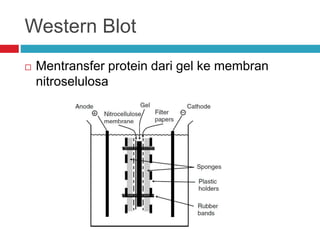
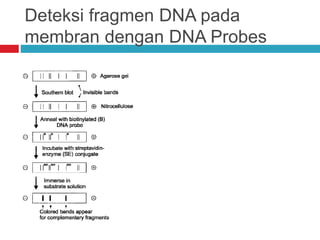
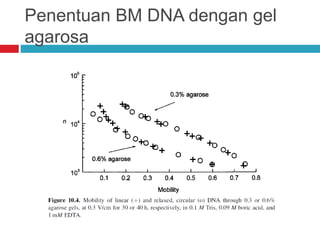
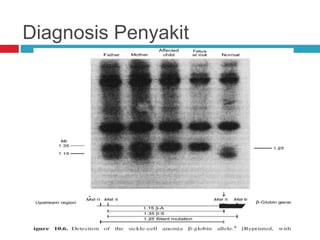
Dokumen tersebut membahas tentang elektroforesis zona, yang merupakan teknik bioanalitik untuk memisahkan dan mengidentifikasi biomolekul berdasarkan perbedaan muatan dan ukuran molekulnya di bawah pengaruh medan listrik. Dokumen tersebut menjelaskan prinsip, jenis media, faktor yang mempengaruhi, dan aplikasi dari teknik elektroforesis zona ini.



























![Bakteri asam laktat ( BAL ) yang dikenal sebagai
mikroorganisme yang memiliki sifat probiotik . Mereka
dapat menghasilkan senyawa penghambat seperti asam
laktat , hidrogen peroksida , diasetil , asetal dehyde dan
bakteriosin . Senyawa ini mampu menghambat
pertumbuhan mikroorganisme berbahaya
Bandeng yang berkembang biak di perairan payau memiliki
karakteristik bertubuh ramping , sirip bercabang , sisik
berdaging seperti kaca dan putih . Ini memiliki keunikan ,
yang mulutnya ompong dan dasar rumput laut konsumsi
makanan . Selain itu , panjang usus dari bandeng 9 kali
lebih panjang dari panjang tubuh ( Murtidjo [ 4 ] ) . Dalam
usus panjang , ada berbagai jenis bakteri termasuk bakteri
asam laktat ( BAL ) , yang membantu proses pencernaan
makanan . BAL juga berfungsi bakteri antagonis terhadap
bakteri patogen . Bakteri asam laktat dapat diisolasi dan
diuji aktivitas antagonis terhadap bakteri patogen dan
dapat dikembangkan sebagai antibiotik baru .
Urutan gen rRNA 16s adalah teknik molekuler untuk
mengidentifikasi mikroorganisme hingga tingkat spesies .
Metode ini telah dianggap sebagai salah satu alat canggih
ditingkat molekuler untuk mengidentifikasi bakteri yang
diisolasi . analisis 16S rRNA telah memfasilitasi studi
populasi mikroba tanpa budidaya berdasarkan penilaian
kuantitatif darikeanekaragaman mikroba saat ini (
Subramani , Aalbersberg [ 9 ] ) .Tujuan dari penelitian ini
adalah untuk mengembangkan PCR 18s rRNA untuk
secara bersamaan mendeteksi spesies Lactobacillus
dalam reaksi tunggal .](https://image.slidesharecdn.com/presentasi-160912103739/85/Presentasi-48-320.jpg)