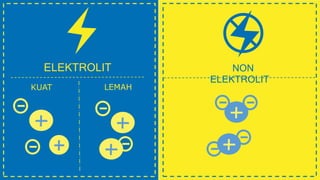
Dokumen tersebut memberikan penjelasan tentang definisi larutan dan unsur-unsurnya seperti zat terlarut dan pelarut, serta berbagai karakteristik larutan seperti molaritas, molalitas, normalitas, dan fraksi mol. Dokumen ini juga menjelaskan faktor yang mempengaruhi kelarutan suatu zat dan karakteristik elektrolit yang kuat dan lemah.