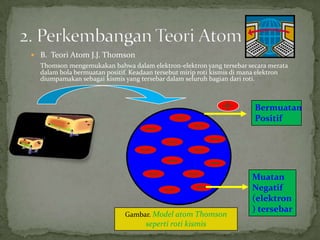
Dokumen ini membahas partikel penyusun atom, yaitu proton, elektron, dan neutron, serta perkembangan teori atom dari Dalton, Thomson, Rutherford, hingga Bohr. Setiap teori memiliki kelebihan dan kekurangan dalam menjelaskan struktur dan sifat atom. Teori-teori tersebut menunjukkan evolusi pemahaman manusia tentang komposisi materi dan interaksi partikel dalam atom.