Makalah ini membahas hukum-hukum termodinamika dan aplikasinya dalam kehidupan sehari-hari, menjelaskan perubahan energi, usaha, dan kalor dalam sistem termodinamik. Tujuan dari makalah ini adalah untuk memberikan pemahaman yang lebih baik tentang prinsip-prinsip dasar termodinamika, termasuk hukum pertama dan kedua, serta berbagai proses yang berlaku. Penulis juga mengharapkan umpan balik untuk memperbaiki makalah ini di masa mendatang.




















![Pemanasan adiabatik juga terjadi di atmosfer bumi ketika massa udara turun, misalnya,
dalam angin katabatic atau Foehn atau chinook angin mengalir menurun selama pegunungan.
Ketika sebidang udara turun, tekanan pada peningkatan paket. Karena ini peningkatan tekanan,
volume paket ini menurun dan suhu yang meningkat, sehingga meningkatkan energi internal.
Pendinginan adiabatik terjadi ketika tekanan zat menurun karena tidak bekerja pada
sekitarnya. Pendinginan adiabatik terjadi di atmosfer bumi dengan mengangkat orografis dan
gelombang lee , dan ini dapat membentuk pileus atau awan lenticular jika udara didinginkan di
bawah titik embun . Ketika tekanan diterapkan pada sebidang menurun udara, udara dalam paket
diperbolehkan untuk memperluas, dengan meningkatnya volume, suhu turun dan energi internal
berkurang.
Pendinginan adiabatik tidak harus melibatkan cairan. Salah satu teknik yang digunakan
untuk mencapai suhu yang sangat rendah (seperseribu bahkan sepersejuta derajat di atas nol
mutlak) adalah demagnetisation adiabatik , di mana perubahan medan magnet pada bahan
magnetik yang digunakan untuk menyediakan pendinginan adiabatik. Juga, isi dari alam
semesta yang mengembang . (untuk urutan pertama) dapat digambarkan sebagai cairan
pendingin adiabatik (Lihat - kematian Panas alam semesta )
Magma naik juga mengalami pendinginan adiabatik sebelum letusan, sangat signifikan dalam
kasus magma yang naik dengan cepat dari kedalaman besar seperti kimberlites . [3]
Perubahan suhu tersebut dapat diukur dengan menggunakan hukum gas ideal , atau persamaan
hidrostatik untuk proses atmosfer.
Proses Tidak ada benar-benar adiabatik. Banyak proses yang dekat dengan adiabatik dan dapat
dengan mudah didekati dengan menggunakan asumsi adiabatik, tapi selalu ada beberapa
kehilangan panas, karena tidak ada isolator yang sempurna ada.
Ideal gas (proses reversible)](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-23-320.jpg)







![ = Panas spesifik pada volume konstan
Proses Isenthalpic
Sebuah proses isenthalpic proses atau isoenthalpic adalah proses yang berlangsung tanpa
perubahan entalpi , H, atau entalpi spesifik , h.
Dalam proses tunak, steady-aliran, perubahan yang signifikan pada tekanan dan suhu dapat
terjadi pada cairan dan belum proses akan isenthalpic jika tidak ada transfer panas ke atau dari
lingkungan, tidak ada kerja yang dilakukan pada atau oleh lingkungan , dan tidak ada perubahan
energi kinetik dari cairan. (Jika proses tunak, steady-aliran dianalisis dengan menggunakan
kontrol volume segala sesuatu di luar kendali volume dianggap lingkungan. )
The Proses throttling adalah contoh yang baik dari proses isenthalpic. Pertimbangkan
pencabutan katup lega atau katup pengaman pada bejana tekan. Entalpi spesifik dari cairan di
dalam bejana tekan adalah sama dengan entalpi spesifik rumit karena lolos dari katup. [2]
Dengan pengetahuan tentang entalpi spesifik dari cairan, dan tekanan luar bejana tekan, itu
adalah mungkin untuk menentukan suhu dan kecepatan dari fluida melarikan diri.
Dalam proses isenthalpic:
Proses Isenthalpic pada gas ideal mengikuti isoterm sejak .
Proses Quasistatic
Dalam termodinamika , proses quasistatic adalah proses termodinamika yang terjadi jauh
perlahan-lahan. Namun, sangat penting untuk dicatat bahwa tidak ada proses yang sebenarnya
adalah quasistatic. Oleh karena itu dalam prakteknya, proses tersebut hanya dapat didekati
dengan melakukan mereka amat sangat lambat.
quasistatic dan reversibilitas
Sebuah proses quasistatic memastikan bahwa sistem akan pergi melalui urutan negara
yang amat dekat dengan keseimbangan (sehingga sistem tetap dalam keseimbangan quasistatic
), dalam hal proses ini biasanya reversibel . Setiap proses reversibel adalah selalu satu
quasistatic. Namun, beberapa proses quasistatic yang ireversibel, jika ada panas yang mengalir
(dalam atau keluar dari sistem) atau jika entropi sedang dibuat dalam beberapa cara lain. Contoh
dari proses quasistatic yang tidak reversibel adalah kompresi terhadap sistem dengan piston
tunduk gesekan - Meskipun sistem selalu dalam kesetimbangan termal, gesekan memastikan
generasi entropi disipatif, yang secara langsung bertentangan dengan definisi reversibel. Sebuah
contoh penting dari sebuah proses yang bahkan tidak quasistatic adalah lambat pertukaran panas
antara dua mayat di dua temperatur finitely berbeda, di mana nilai tukar panas dikendalikan oleh
kurang adiabatik partisi antara dua badan (Sears dan Salinger, 1986) - di kasus ini, tidak peduli
seberapa lambat proses berlangsung, negara-negara dari dua mayat yang pernah amat dekat](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-31-320.jpg)
![dengan keseimbangan, karena kesetimbangan termal mensyaratkan bahwa dua mayat berada
tepat pada suhu yang sama.
Beberapa ambiguitas ada dalam literatur mengenai perbedaan antara proses quasistatic
dan reversibel, karena ini kadang-kadang diambil sebagai sinonim ( Bernard H Lavenda , 1978).
Alasannya justru karena teorema terbukti bahwa setiap proses reversibel juga merupakan salah
satu quasistatic, meskipun kami juga telah menunjukkan bahwa Kebalikannya tidak benar. Hal
ini praktis tidak berguna untuk membedakan antara kedua karena insinyur pun akan ingat untuk
memasukkan gesekan ketika menghitung generasi entropi disipatif. Definisi di atas lebih dekat
dengan pemahaman intuitif dari kata "quasi-" (hampir) "statis", namun tetap secara teknis
berbeda dari proses reversibel .
PV-Work di berbagai kuasi-statis proses
1. Konstan tekanan: proses isobaric ,
2. Konstan volume: proses isochoric ,
3. Suhu konstan: proses isotermal ,
Hubungan dengan proses yang ideal
Untuk nilai-nilai tertentu dari indeks polytropic, proses akan identik dengan proses umum
lainnya. Beberapa contoh dampak dari berbagai nilai indeks diberikan dalam tabel.
Variasi indeks polytropic
Polytropic
indeks
Hubungan Efek
-
Meskipun tidak berlaku untuk sistem sehari-hari, eksponen negatif
dapat berarti dalam beberapa kasus khusus yang tidak didominasi
oleh interaksi termal, seperti dalam proses plasma tertentu dalam
astro-fisika. [1]
(Konstan)
Setara dengan proses isobarik (konstan tekanan )](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-32-320.jpg)
![(Konstan)
Setara dengan proses isotermal (konstan suhu )
-
Sebuah proses kuasi-adiabatik seperti dalam mesin pembakaran
internal selama ekspansi, atau dalam refrigerasi kompresi uap
selama kompresi
- adalah indeks adiabatik , menghasilkan suatu proses
adiabatik (tidak ada panas yang ditransfer)
- Setara dengan proses isochoric (konstan Volume )
Ketika indeks n adalah antara dua nilai mantan (0, 1, gamma, atau tak terhingga), itu berarti
bahwa kurva polytropic [ klarifikasi diperlukan ]
akan dibatasi oleh kurva dari dua indeks yang sesuai.
Perhatikan bahwa , Karena .
Sebuah solusi untuk persamaan Lane-Emden menggunakan cairan polytropic dikenal sebagai
polytrope .
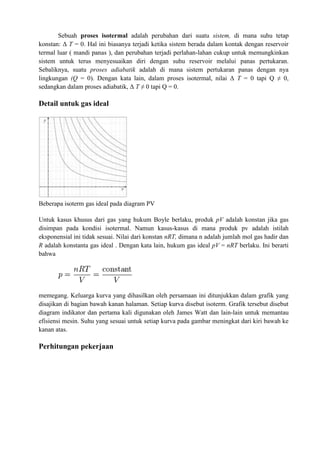
2.3 Menentukan Usaha Luar Secara Grafik
Usaha luar yang dilakukan oleh gas pada tekanan tidak tetap dapat dinyatakan dalam
diagram p – V, yang besarnya sebanding dengan luas daerah di bwah kurva.
Proses kearah kanan
V2 > V1, berarti W positif
W = p ( V2 – V1 )
Proses kearah kiri
V2 < V1, berarti W negative
W = -p ( V2 – V1 )
Proses berbentuk siklus
Proses 1 ke 2 > W 0
Proses 2 ke 3 > W positif
Proses 3 ke 4 > W 0
Proses 4 ke 1 > W negative
Wtotal = ∆𝑝 . ∆𝑉
= ( p2 – p1 ) . ( V2 – V1 )
2.4 Hukum Ke Nol termodinamika
The zeroth hukum termodinamika adalah prinsip generalisasi dari kesetimbangan
termal antara badan-badan, atau sistem termodinamika , kontak.
Hukum zeroth menyatakan bahwa jika dua sistem berada dalam kesetimbangan termal
dengan sistem ketiga, mereka juga dalam kesetimbangan termal dengan satu sama lain.](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-33-320.jpg)
![Sistem dikatakan berada dalam kesetimbangan termal jika mereka mampu mentransfer
panas antara satu sama lain (misalnya dengan konduksi atau radiasi) tetapi tidak melakukannya.
Sistem juga dapat dikatakan berada dalam kesetimbangan termal jika mereka tidak dapat
mentransfer panas ke satu sama lain, tetapi tidak akan melakukannya jika mampu. Hukum
menyiratkan bahwa keseimbangan termal antara sistem adalah hubungan transitif , yang
memberikan definisi parameter fisik yang empiris, yang disebut temperatur . Suhu adalah sama
untuk semua sistem dalam kesetimbangan termal. Hukum memungkinkan pembangunan
termometer untuk mengukur properti ini.
Hukum zeroth sebagai hubungan kesetaraan
Suatu sistem dikatakan berada dalam kesetimbangan termal ketika tidak mengalami
perubahan bersih energi panas. Jika A, B, dan C yang berbeda sistem termodinamika , hukum
zeroth dari termodinamika dapat dinyatakan sebagai:
Jika A dan C masing-masing dalam kesetimbangan termal dengan B, A juga dalam
kesetimbangan dengan C.
Pernyataan ini menegaskan bahwa kesetimbangan termal adalah hubungan Euclidean antara
sistem termodinamika. Jika kita juga mengakui bahwa semua sistem termodinamika berada
dalam kesetimbangan termal dengan diri mereka sendiri, maka kesetimbangan termal juga
merupakan hubungan refleksif . Hubungan yang baik refleksif dan Euclidean adalah hubungan
kesetaraan . Salah satu konsekuensi dari penalaran ini adalah bahwa kesetimbangan termal
adalah hubungan transitif : Jika A berada dalam kesetimbangan termal dengan B dan B berada
dalam kesetimbangan termal dengan C, maka A berada dalam kesetimbangan termal dengan C.
Konsekuensi lain adalah bahwa hubungan kesetimbangan simetris : Jika A berada dalam
kesetimbangan termal dengan B, maka B berada dalam kesetimbangan termal dengan A. Dengan
demikian kita dapat mengatakan bahwa dua sistem berada dalam kesetimbangan termal dengan
satu sama lain, atau bahwa mereka berada dalam kesetimbangan bersama. Secara implisit
dengan asumsi kedua refleksivitas dan simetri, hukum zeroth Oleh karena itu sering dinyatakan
sebagai :
Jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, maka mereka berada
dalam kesetimbangan termal dengan satu sama lain.
Sekali lagi, secara implisit dengan asumsi kedua refleksivitas dan simetri, hukum zeroth kadang-
kadang dinyatakan sebagai hubungan transitif: [4]
Jika A berada dalam kesetimbangan termal dengan B dan jika B berada dalam kesetimbangan
termal dengan C, maka A berada dalam kesetimbangan termal dengan C.
Thermal keseimbangan antara banyak sistem
Banyak sistem dikatakan dalam kesetimbangan jika, kecil pertukaran acak (karena gerak
Brown atau emisi foton , misalnya) di antara mereka tidak menyebabkan perubahan bersih pada
total energi dijumlahkan seluruh sistem. Contoh sederhana ini menggambarkan mengapa hukum
zeroth diperlukan untuk melengkapi deskripsi ekuilibrium.](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-34-320.jpg)

![masalah bahkan untuk N yang kemudian mengarah ke kondisi ekuilibrium yang sama yang kita
harapkan dalam setiap kasus, yaitu, . Hasil yang sama berlaku untuk fluktuasi dalam
jumlah yang ekstensif, seperti volume (menghasilkan kondisi tekanan yang sama), atau fluktuasi
massa (yang mengarah ke kesetaraan kimia potensi). Oleh karena itu hukum zeroth memiliki
implikasi bagi banyak lebih dari suhu saja. Secara umum, kita melihat bahwa hukum zeroth
istirahat jenis tertentu asimetri hadir dalam Hukum Pertama dan Kedua.
Hukum zeroth menetapkan keseimbangan termal sebagai hubungan kesetaraan. Sebuah
hubungan kesetaraan pada set (seperti set sistem termal disetimbangkan) membagi set yang
menjadi koleksi himpunan bagian yang berbeda ("disjoint subset") di mana setiap anggota
himpunan adalah anggota dari satu dan hanya satu bagian tersebut. Dalam kasus hukum ke nol,
ini terdiri dari subset sistem yang berada dalam kesetimbangan bersama. Partisi ini
memungkinkan setiap anggota subset untuk menjadi unik "ditandai" dengan label
mengidentifikasi subset mana ia berasal. Meskipun label mungkin cukup sewenang-wenang, [5]
suhu adalah seperti proses pelabelan yang menggunakan sistem bilangan real untuk penandaan.
Hukum zeroth membenarkan penggunaan sistem termodinamika cocok sebagai termometer
untuk memberikan seperti pelabelan, yang menghasilkan sejumlah kemungkinan skala
temperatur empiris , dan membenarkan penggunaan hukum kedua termodinamika untuk
memberikan mutlak, atau suhu termodinamika skala. Skala temperatur tersebut membawa
kelangsungan tambahan dan memesan (misalnya, "panas" dan "dingin") properti dengan konsep
temperatur.
Dalam ruang parameter termodinamika, zona suhu konstan membentuk permukaan,
yang menyediakan tatanan alam dari permukaan di dekatnya. Satu Oleh karena itu dapat
membangun fungsi suhu global yang menyediakan pemesanan terus menerus negara. The
dimensi dari permukaan suhu konstan adalah salah satu kurang dari jumlah parameter
termodinamika, dengan demikian, untuk gas ideal digambarkan dengan tiga parameter
termodinamika P, V dan n, itu adalah dua- dimensi permukaan.
Misalnya, jika dua sistem gas yang ideal berada dalam kesetimbangan, maka P 1 V 1 / N 1 = P 2
V 2 / N 2 di mana P i adalah tekanan dalam sistem ke-i, V i adalah volume, dan N i adalah jumlah
(dalam mol , atau hanya jumlah atom) gas.
Permukaan PV / N = const mendefinisikan permukaan suhu termodinamika yang sama, dan satu
dapat label T mendefinisikan sehingga PV / N = RT, di mana R adalah beberapa konstan. Sistem
ini sekarang dapat digunakan sebagai termometer untuk mengkalibrasi sistem lain. Sistem
tersebut dikenal sebagai "termometer gas ideal".
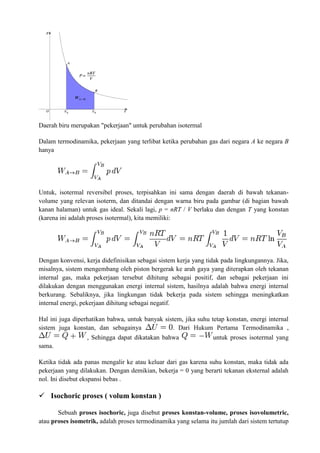
2.5 Hukum I Termodinamika
a. Pernyataan Hukum I Termodinamika
Hukum pertama termodinamika berhubungan dengan cara suatu sistem
memperoleh energi dalam dari lingkungan atau kehilangan energi dalam ke lingkungan.
Jika suatu sistem memperoleh energi Q dalam bentuk kalor dan pada saat yang sama
kehilangan energi W dalam bentuk usaha, perubahan energi dalam karena kedua faktor
ini dinyatakan oleh persamaan: ΔU = U2 – U1 = Q – W. Jadi, hukum pertama](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-36-320.jpg)






![3: sebagai salah satu bebas untuk memilih nol entropi akan lebih mudah untuk mengambil
(9)
sehingga persamaan. (7) tereduksi menjadi bentuk akhir
(10)
Makna fisik Persamaan. (9) adalah lebih dari sekedar pilihan yang nyaman dari nol entropi. Hal
ini karena urutan yang sempurna nol kelvin seperti yang dijelaskan sebelumnya.
Konsekuensi dari hukum ketiga
Gambar 1 Sisi Kiri: Absolute nol dapat dicapai dalam jumlah terbatas langkah-langkah jika S (0,
X 1) ≠ S (0, X 2). Kanan: Sebuah jumlah tak terbatas langkah ini diperlukan karena S (0, X 1) = S
(0, X 2).
Hukum ketiga adalah setara dengan pernyataan bahwa
"Tidak mungkin dengan prosedur apapun, tidak peduli seberapa ideal, untuk mengurangi
suhu sistem apapun ke nol suhu dalam jumlah terbatas operasi terbatas".
Alasan bahwa T = 0 tidak dapat dicapai sesuai dengan hukum ketiga dijelaskan sebagai berikut:
Misalkan suhu suatu zat dapat dikurangi dalam proses isentropik dengan mengubah parameter X
dari X 2 X 1. Salah satu bisa memikirkan multistage demagnitization nuklir setup dimana medan
magnet dihidupkan dan dimatikan dengan cara yang terkontrol. [8]
Jika akan ada perbedaan
entropi pada nol mutlak T = 0 dapat dicapai dalam jumlah terbatas langkah. Namun, pada T = 0
tidak ada perbedaan entropi sehingga jumlah tak terbatas langkah akan diperlukan. Proses ini
diilustrasikan dalam Gambar 1.
panas spesifik](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-45-320.jpg)





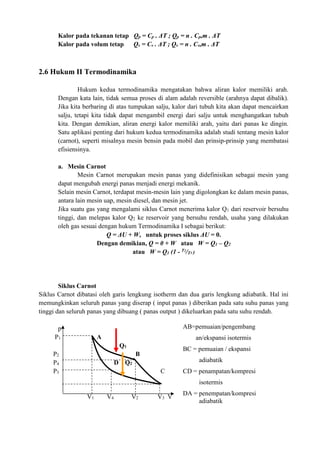
![Contoh sistem nyata dimodelkan dengan proses ideal: PV dan TS diagram siklus Brayton
dipetakan ke proses aktual dari mesin turbin gas
Siklus termodinamika dapat digunakan untuk model perangkat nyata dan sistem,
biasanya dengan membuat serangkaian asumsi. asumsi penyederhanaan sering diperlukan untuk
mengurangi masalah ke bentuk yang lebih mudah dikelola. Sebagai contoh, seperti yang
ditunjukkan pada gambar, perangkat seperti turbin gas atau mesin jet dapat dimodelkan sebagai
siklus Brayton . Perangkat yang sebenarnya terdiri dari serangkaian tahap, masing-masing itu
sendiri dimodelkan sebagai proses termodinamika ideal. Meskipun setiap tahap yang bekerja
pada fluida kerja adalah perangkat nyata yang kompleks, mereka dapat dimodelkan sebagai
proses ideal yang mendekati perilaku nyata mereka. Asumsi selanjutnya adalah bahwa gas
buang akan diteruskan kembali melalui inlet dengan kerugian yang sesuai panas, sehingga
menyelesaikan siklus ideal.
Perbedaan antara siklus ideal dan performa sebenarnya dapat menjadi signifikan. [2]
Sebagai
contoh, gambar berikut menggambarkan perbedaan dalam output kerja diprediksi oleh ideal
siklus Stirling dan kinerja aktual dari mesin Stirling:
Ideal Stirling siklus Realisasi kinerja
Aktual dan ideal dilapis,
menunjukkan perbedaan
dalam output kerja](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-51-320.jpg)


![siklus reversibel lainnya yang menggunakan regenerasi untuk mendapatkan perpindahan panas
isotermal.
Stirling siklus
Siklus Stirling adalah seperti siklus Otto, kecuali bahwa adiabats diganti dengan isoterm.
Hal ini juga sama dengan siklus Ericsson dengan proses isobaric diganti untuk proses volume
konstan.
1. TOP dan BOTTOM dari loop: sepasang kuasi-paralel proses isotermal
2. KIRI dan KANAN sisi loop: sepasang proses paralel isochoric
Panas mengalir ke loop melalui isoterm atas dan isochore kiri, dan beberapa dari panas ini
mengalir kembali keluar melalui isoterm bawah dan isochore yang tepat, tetapi sebagian besar
aliran panas adalah melalui sepasang isoterm. Hal ini masuk akal karena semua pekerjaan yang
dilakukan oleh siklus dilakukan oleh sepasang proses isotermal, yang dijelaskan oleh Q = W.
Hal ini menunjukkan bahwa semua panas bersih masuk melalui isoterm atas. Bahkan, semua
panas yang datang melalui isochore kiri keluar melalui isochore yang tepat: karena isoterm atas
adalah semua pada suhu yang lebih hangat yang sama dan isoterm bawah adalah semua pada
temperatur dingin yang sama , Dan karena perubahan dalam energi untuk isochore suatu
sebanding dengan perubahan suhu, maka semua panas yang masuk melalui isochore kiri
dibatalkan tahu persis oleh panas akan keluar isochore yang tepat.
2.9 Tabel persamaan termodinamika
jumlah pokok Umum
Kuantitas (Nama umum / s)
(Umum) Simbol /
s
SI Unit Dimensi
Jumlah molekul N berdimensi berdimensi
Jumlah mol n mol [N]
Suhu T K [Θ]
Panas Energi Q, q J [M] [L] 2
[T] -2
Laten Panas Q L J [M] [L] 2
[T] -2
jumlah berasal Umum
Kuantitas (Nama
umum / s)
(Umum)
Simbol / s
Mendefinisikan Persamaan SI Unit Dimensi
Termodinamika
beta suhu, Inverse
β J -1 [T] 2
[M] -1
[L] -2
Entropi S JK -1 [M] [L] 2
[T] -2
[Θ] -1
Negentropy J JK -1 [M] [L] 2
[T] -2
[Θ] -1](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-54-320.jpg)
![Energi internal U J
[M] [L] 2
[T] -2
Entalpi H J
[M] [L] 2
[T] -2
Partisi Fungsi Z berdimensi berdimensi
Energi bebas Gibbs G J
[M] [L] 2
[T] -2
Kimia potensial
(dari
komponen i dalam
campuran)
μ i
(N i, S, V semua harus
konstan)
J
[M] [L] 2
[T] -2
Energi bebas
Helmholtz
Sebuah F, J
[M] [L] 2
[T] -2
Landau potensial ,
Landau Gratis
Energy
Ω J
[M] [L] 2
[T] -2
Potensi besar Φ G J
[M] [L] 2
[T] -2
Massieu Potensi,
Helmholtz gratis
entropi
Φ JK -1 [M] [L] 2
[T] -2
[Θ] -1
Planck potensial,
Gibbs bebas entropi
Ξ JK -1 [M] [L] 2
[T] -2
[Θ] -1
Thermal sifat materi
Kuantitas
(nama
umum / s)
(Umum
) simbol
/ s
Mendefinisikan persamaan SI unit Dimensi
Umum
panas /
kapasitas
termal
C JK -1
[M] [L] 2
[T] -2
[Θ] -
1
Kapasitas
panas
(isobarik)
C p JK -1
[M] [L] 2
[T] -2
[Θ] -
1
Kapasitas
panas
spesifik
(isobarik)
C mp J kg -1
K -1 [L] 2
[T] -2
[Θ] -1
Molar
kapasitas
panas
C np
JK -1
mol -
1
[M] [L] 2
[T] -2
[Θ] -
1
[N] -1](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-55-320.jpg)
![spesifik
(isobarik)
Kapasitas
panas
(isochoric /
volumetrik
)
C V JK -1
[M] [L] 2
[T] -2
[Θ] -
1
Kapasitas
panas
spesifik
(isochoric)
C mV J kg -1
K -1 [L] 2
[T] -2
[Θ] -1
Molar
kapasitas
panas
spesifik
(isochoric)
C nV
JK -1
mol -
1
[M] [L] 2
[T] -2
[Θ] -
1
[N] -1
Spesifik
panas laten
L J kg -1
[L] 2
[T] -2
Rasio
isobarik
terhadap
kapasitas
panas
isochoric,
panas rasio
kapasitas
indeks,
adiabatik
γ
berdimens
i
berdimens
i
Thermal transfer
Kuantitas (nama umum /
s)
(Umum)
simbol / s
Mendefinisikan
persamaan
SI unit Dimensi
Suhu gradien
Tidak ada
simbol
standar
K m -1
[Θ] [L] -1
Konduksi termal tingkat,
termal saat ini, termal /
panas fluks , transfer
daya termal
P
W = J s
-1
[M] [L] 2
[T] -2
Thermal intensitas Saya W m -2
[M] [T] -3
Termal / panas kerapatan
fluks (vektor analog
intensitas termal di atas)
q W m -2
[M] [T] -3](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-56-320.jpg)

![Tekanan gas
ideal
m = massa satu
molekul
M m = massa molar
gas Ideal
Kuan
titas
Persamaan Umum
Isobarik
Δ p = 0
Isochoric
Δ V = 0
Isoterm
al
Δ T = 0
Adiabatik
Beker
ja
W
Panas
Kapa
sitas
C
(Seperti untuk gas
nyata)
(Untuk
gas ideal
monoato
mik)
(Untuk
gas ideal
monoato
mik)
Energ
i
intern
al
Δ U
Ental
pi
Δ H
Entro
pi
Δ S
[1]
Konst
an
Entropi
, Di mana k B adalah konstanta Boltzmann , dan Ω menunjukkan volume
macrostate di ruang fase atau probabilitas termodinamika dinyatakan disebut.
, Untuk proses reversibel hanya](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-58-320.jpg)


![dan terkait hubungan termodinamika mendasar atau "persamaan master" [2]
adalah:
Potensi Diferensial
Energi internal
Entalpi
Energi bebas Helmholtz
Energi bebas Gibbs
hubungan Maxwell
Empat yang paling umum hubungan Maxwell adalah:
Fisik Situasi Tata nama Persamaan
Termodinamika
potensi sebagai
fungsi dari variabel
alami mereka
=
internal energi
=
Entalpi
=
energi bebas
Helmholtz
=
energi bebas
Gibbs
Hubungan mencakup berikut ini.
Persamaan diferensial lainnya adalah:
Nama H U G](https://image.slidesharecdn.com/makalahtermodinamikaedit-221106124838-6e4302dc/85/MAKALAH-TERMODINAMIKA-EDIT-docx-61-320.jpg)









