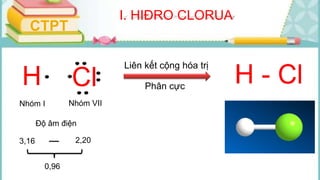
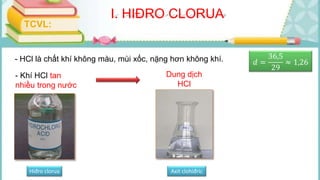
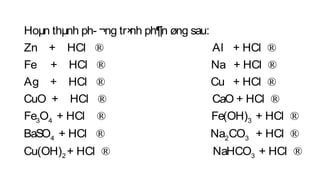
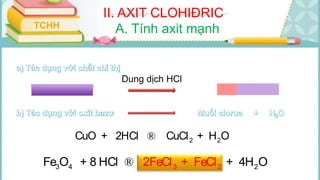
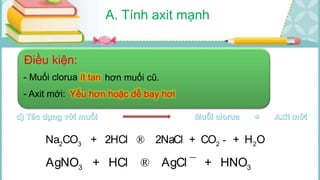
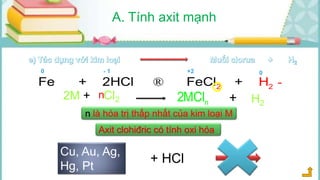
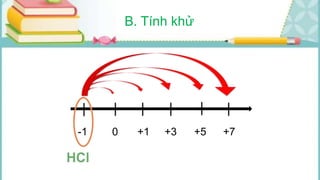
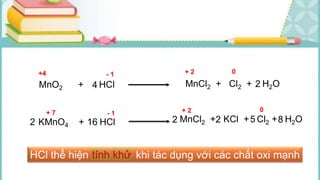
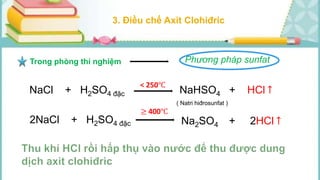
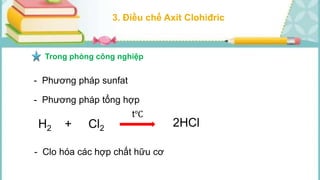
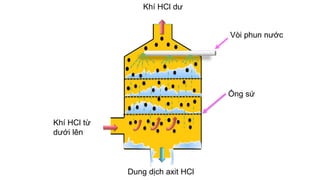
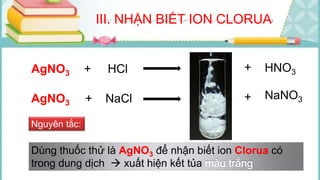
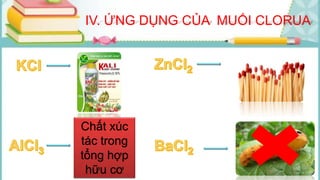
Tài liệu mô tả các phản ứng hóa học của khí hiđro clorua (HCl) với nhiều chất khác nhau, bao gồm kim loại và dung dịch kiềm. HCl là một axit mạnh, không màu, hòa tan tốt trong nước và có nhiều ứng dụng trong công nghiệp. Các phương pháp điều chế HCl trong phòng thí nghiệm và công nghiệp cũng được trình bày, cùng với cách nhận biết ion clorua.