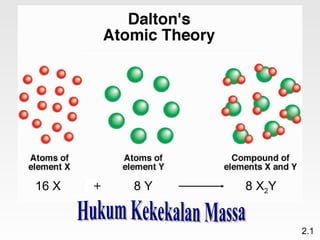
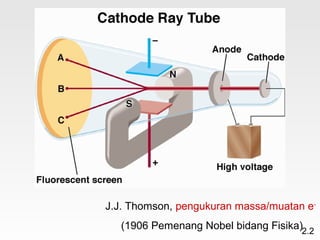
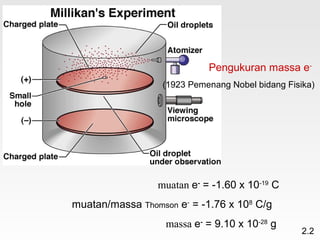
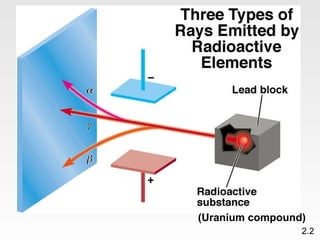
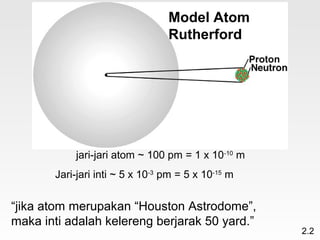
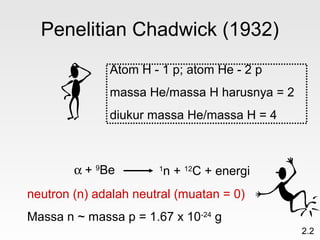
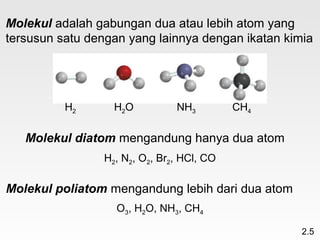
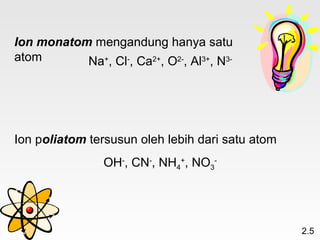
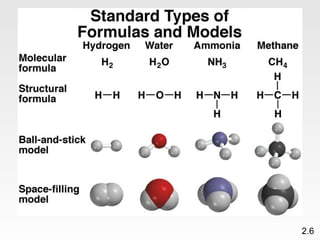
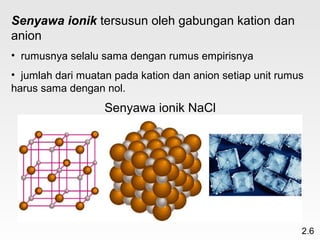
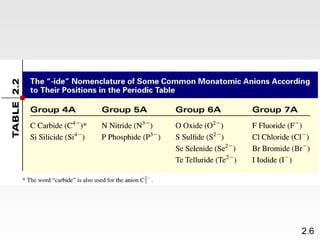
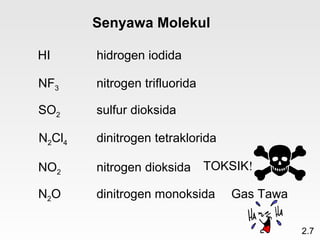
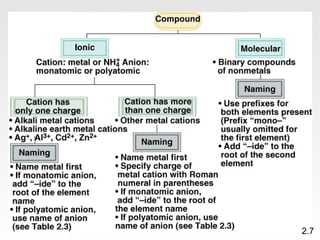
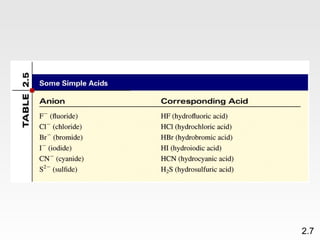
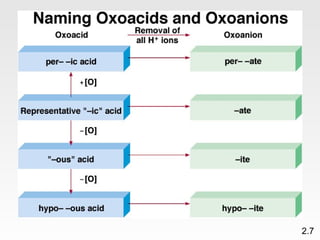
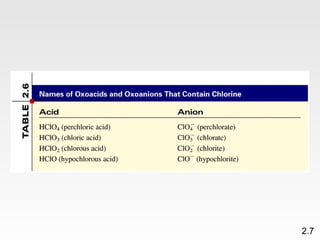
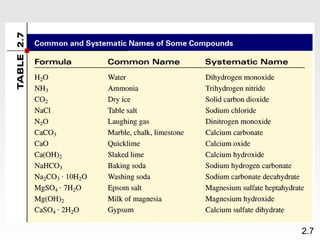
Dokumen membahas teori atom dari Dalton hingga model modern yang melibatkan penemuan proton, neutron, dan elektron. Menjelaskan juga tentang unsur, senyawa, ion, serta struktur atom dan bagaimana atom berinteraksi melalui reaksi kimia. Selain itu, dokumen menjelaskan perbedaan antara rumus molekul dan rumus empiris serta penamaan senyawa ion dan molekul.