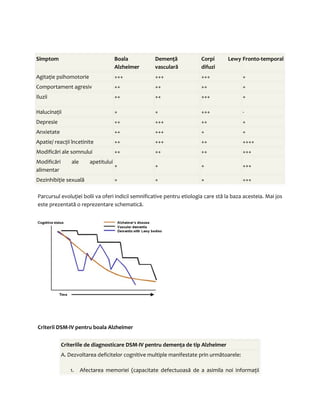
Creierul uman, de aproximativ 1.4 kilograme, este format din encefal, cerebel și trunchi cerebral, având roluri esențiale în funcții cognitive, control muscular și autoreglementare. Materia cenușie și materia albă constituie structurile principale, fiecare având funcții determinate în procesarea informațiilor și controlul funcțiilor autonome. Sistemul limbic, care include hipocampul și amigdala, este crucial pentru emoții și memorie, iar tulburările asociate cu diferite regiunii ale creierului pot influența sănătatea mentală.





















![desfăşurat de Institutul Naţional de Sănătate Mentală, a indicat că prevalenţa combinată a
tulburării de panică, TOC şi a fobiilor s-a situat între 5.7% şi 33% în rândul persoanelor în vârstă
(Jenike, 1996). Fobiile au fost cea mai comună tulburare psihică în rândul femeilor vârstnice
şi a doua cea mai comună tulburare la bărbaţii vârstnici, iar aproximativ 10–15% dintre femeile
cu vârsta peste 65 de ani au experimentat anxietatea într-o măsură suficient de severă
pentru a necesita intervenţia medicală. Un studiu cu subiecţi vârstnici care locuiau în imobile
comunitare a demonstrat că 20% din populaţia studiată a experimentat nivele îngrijorătoare
de anxietate, iar în cadrul cabinetelor de medicină primară s-a observat că ocurenţa
anxietăţii creşte odată cu vârsta, aproape 30% dintre persoanele cu vârsta de 70 de ani
prezentând anxietate.
Numeroşi factori, precum pierderea prietenilor şi a celor dragi, degradarea sănătăţii, declinul
intelectual, sentimentele de neajutorare şi inutilitate şi pierderea controlului asupra mediului
lor imediat, precum şi schimbările neurologice care survin cu vârsta, îi pot sensibiliza pe
vârstnici, astfel încât să dezvolte anxietate.
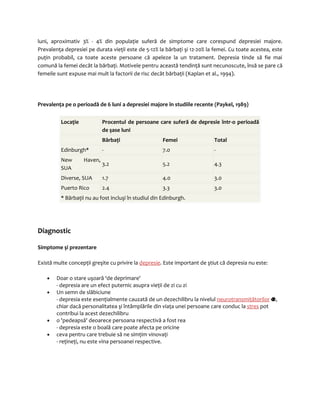
Diagnostic
Primele simptome ale unei tulburări anxioase (vezi Tabelul 2) survin de obicei relativ timpuriu în viaţă,
iar evoluţia bolii este adeseori cronică, cu episoade recurente sau de recidivă şi cu perioade de
dizabilitate.
Tulburările anxioase sunt manifestări mentale şi psihice ale anxietăţii. Sentimentele de anxietate nu
pot fi atribuite unui pericol real şi se prezintă fie sub forma unor atacuri, fie sub forma unei stări
persistene.
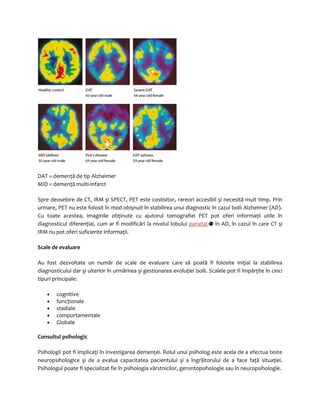
Tabelul 2: Simptomele uzuale ale tulburărilor anxioase
· Fobia: o teamă nefirească, iraţională faţă de un obiect sau o situaţie,
despre care persoana anxioasă realizează că nu este
periculos/periculoasă, însă continuă să ia măsuri de a-l/ a o evita
· Egodistonic: gânduri, sentimente sau acţiuni care nu sunt obişnuite sau
care nu se încadrează într-un comportament normal (ego [sine]; distonic
[străin])
· Compulsie: un impuls, imbold sau o dorinţă de a realiza o acţiune
iraţională, care reduce anxietatea şi care este văzut/văzută ca fiind
egodistonic/ă; spre exemplu, spălatul pe mâini în mod repetat sau
numărarea paşilor făcuţi
· Obsesie: o idee, emoţie sau un gând ori impuls care este repetitiv/ă,
nedorit/ă şi care provoacă anxietate; spre exemplu, impulsul constant de
a se spăla pe mâini sau de a număra obiecte; persoana anxioasă se poate
simţi neliniştită că s-a gândit la o acţiune, dar că nu a săvârşit-o
· Panica: o anxietate bruscă, copleşitoare care produce spaimă şi schimbări
fiziologice şi psihologice](https://image.slidesharecdn.com/atlascerebral-141019144624-conversion-gate02/85/Atlas-cerebral-23-320.jpg)























































































































![Parkinsonism secundar
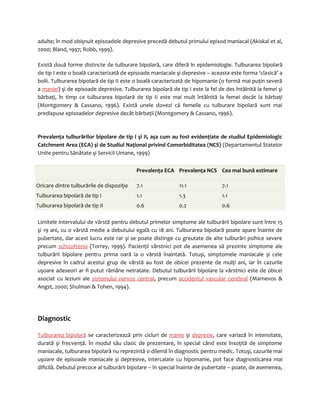
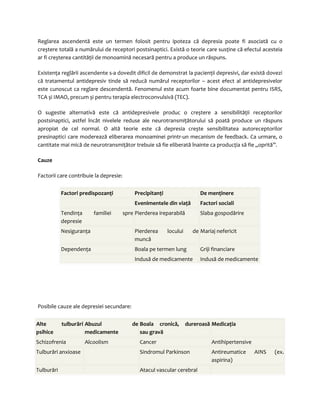
Provocarea diagnosticării MP estre departe de a fi neînsemnată, deoarece anumite forme de
parkinsonism secundar nu pot fi diferenţiate clinic de MP. Câteva cauze notabile ale parkinsonismului
secundar sunt enumerate în Tabelul 4.
O seri de alte afecţiuni degenerative, prezentate în Tabelul 5, pot produce akinezie şi/sau rigiditate pe
durata evoluţiei naturale. Orice detalii privind aceste afecţiuni nu intră în sfera de incidenţă a acestei
discuţii.
Scala de Evaluare a Maladiei Parkinson
Evaluarea cantitativă a MP prin intermediul tehnicilor de imagistică este încă imposibil de inclus în
practica clinică de rutină şi în evaluările calitative standardizate – scalele de evaluare – rămân metoda
optimă de evaluare şi urmărire a evoluţiei persoanelor cu MP.
Cea mai răspândită asemenea scală de evaluare este Scala Unificată de Evaluare a Maladiei Parkinson
(UPDRS), formată din 42 de itemi, fiecare punctat pe o scală de cinci puncte (0–4). Scala permite o
evaluare relativ consecventă a stării psihice a unei persoane, activităţilor vieţii cotidiene, funcţiei
motorii şi complicaţiilor terapiei.
UPDRS poate fi completată, în special prin testul „Second Step” de evaluare a nivelului de
dizabilitate. În plus, persoanele cu MP suferă deseori de afecţiuni comorbide [Legătură către
secţiunea Comorbiditate din secţiunea despre maladia Parkinson], precum depresia; utilizarea
scalelor specifice acestor afecţiuni va fi deseori adecvată pe parcursul gestionării MP.
Evoluţie
Degenerarea neuronală în maladia Parkinson (PD) poate începe cu mulţi ani anterior manifestării
simptomelor clinice. În consecinţă, debutul este atât de insidios, încât persoanele cu MP pot rareori
menţiona momentul observării primelor simptome, iar simptomele timpurii pot fi atât de uşoare,
încât un diagnostic clinic nu poate fi stabilit.
Unele persoane cu MP raportează apariţia primelor simptome pe parcursul perioadelor de stres,
dispariţia şi apoi reapariţia acestora câţiva ani mai târziu (Goetz şi alţii, 1995). Alte persoane cu MP
descriu un istoric al dizabilităţilor care corespunde parkinsonismului, prezent cu mulţi ani anterior
stabilirii unui diagnostic clar. Familiile persoanelor cu MP îşi amintesc deseori modificări motorii şi
psihice subtile care precedă cu câţiva ani diagnosticarea.
Există numeroase dovezi care sugerează progresia rapidă a MP pe parcursul stadiului sub-clinic şi în
primii ani ulteriori apariţiei simptomelor, cu o deteriorare ulterioară mai lentă (Poewe şi Wenning,
1996). Conform studiului privind terapia antioxidativă cu Deprenil şi Tocoferol (DATATOP) şi Scala
unificată de evaluare a maladiei Parkinson (UPDRS), scorurile la examinarea motorie se reduc cu 8–](https://image.slidesharecdn.com/atlascerebral-141019144624-conversion-gate02/85/Atlas-cerebral-149-320.jpg)















































