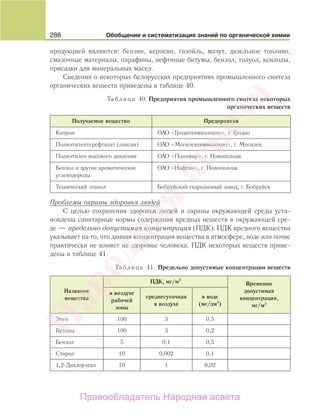
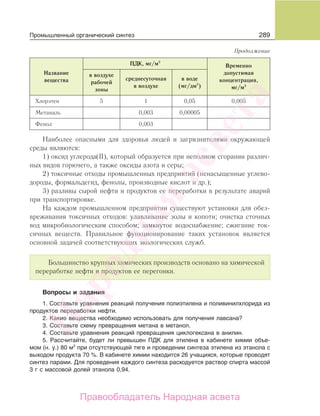
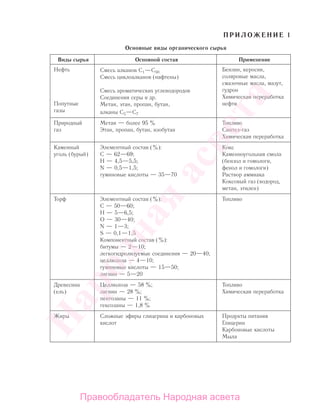
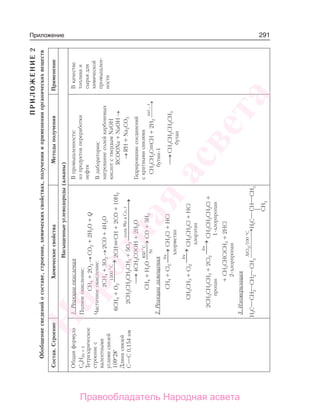
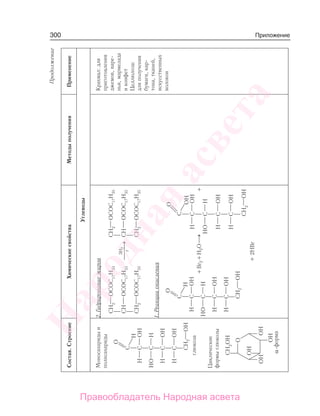
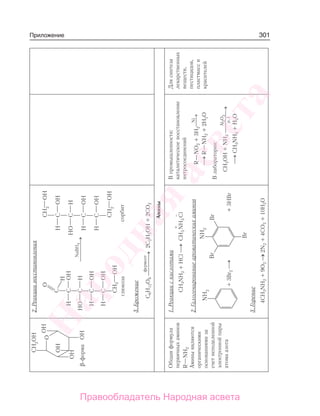
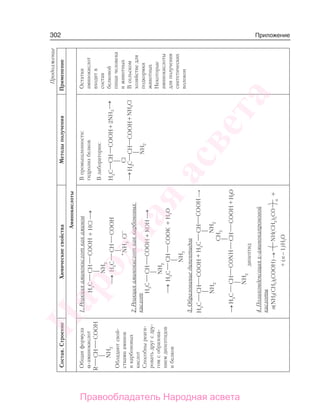
Учебник по органической химии для 11 класса описывает основные понятия, свойства и применение органических соединений, начиная с углеводородов и функциональных производных. Он включает теоретическую информацию, практические задания и лабораторные работы, направленные на формирование практических навыков и интереса к предмету. Также в книге рассматривается важность органической химии в жизни человека и возможные экологические проблемы, связанные с использованием органических веществ.






































































![75
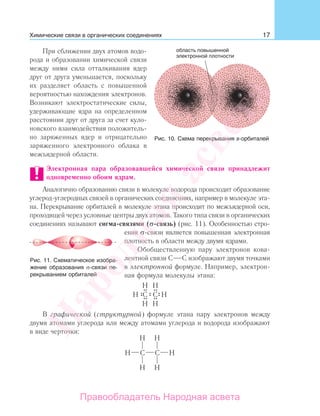
Наличие двойных С С-связей в структурных звеньях данных полимеров
обусловливает возможность существования цис- и транс-стереоизомеров.
Оказалось, что в пространственном строении макромолекул природного каучука
наблюдается строгая регулярность — только цис-расположение заместителей
в структурных звеньях. Полимеры такого строения называют стереорегуляр-
ными.
При получении синтетических каучуков образующиеся макромолекулы по-
лимера построены из хаотично расположенных структурных звеньев в цис- или
транс-формах (нестереорегулярное строение). По этой причине каучуки
нестереорегулярного строения уступают природному каучуку по эластичности
и износостойкости.
Ученым удалось решить проблему синтеза стереорегулярных каучуков, по-
добных природному, при использовании смешанных катализаторов типа [TiCl4,
Al(C2H5)3]:
n(CH2 CH CH CH2)
TiCl , Al(C H )4 2 5 3
⎯⎯⎯⎯⎯⎯⎯ →
⎯→⎯
Эластичность каучуков является одним из важнейших условий при изго-
товлении авиационных и автомобильных шин и улучшается при вулканизации
каучука — превращении каучука в резину при нагревании с серой:
В результате вулканизации физико-механические свойства каучука значи-
тельно улучшаются.
Диены
Народная
асвета
Правообладатель Народная асвета](https://image.slidesharecdn.com/2963-161015095802/85/296-3-11-_-2013-318-75-320.jpg)












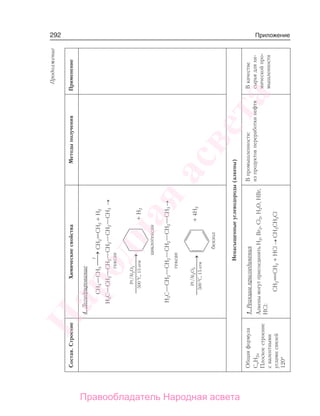
![88 Ароматические углеводороды
Химические свойства
Реакции замещения
Все реакции замещения у бензола происходят таким образом, что атомы водо-
рода молекулы бензола замещаются на частицы, имеющие положительный заряд.
1) Галогенирование. При обработке бензола раствором брома в тетра-
хлорметане в обычных условиях никакой реакции не наблюдается, однако в
присутствии катализаторов (Fe, FeBr3, AlCl3 и др.) бензол вступает в реакцию
замещения. Роль катализатора заключается в поляризации молекулы галогена
с образованием комплекса Br+
[FeBr4]–
. Например, бензол в присутствии любого
из указанных катализаторов реагирует с бромом (рис. 38) или хлором даже при
комнатной температуре:
FeBr
Как видно из уравнения бромирования, при таком соотношении реагентов
любой один атом водорода в молекуле бензола замещается на атом брома.
2) Нитрование. Другим примером реакции замещения является взаимодействие
бензола с азотной кислотой, роль катализатора в которой играет серная кислота:
В обоих случаях — при галогенировании и нит-
ровании — наблюдается сохранение ароматической
структуры молекулы бензола.
Реакции присоединения
В жестких условиях бензол может вступать в
реакции присоединения с потерей ароматической
Рис. 38. Схема реакции бензола с бромом: 1 — бензол;
2 — бром; 3 — раствор брома в бензоле; 4 — АlCl3; 5 —
универсальная индикаторная бумага
Народная
асвета
Правообладатель Народная асвета](https://image.slidesharecdn.com/2963-161015095802/85/296-3-11-_-2013-318-88-320.jpg)














































![139
Затем кумол окисляют, продукт окисления кумола разлагают разбавленной
серной кислотой и получают при этом фенол и ацетон (СН3СОСН3), важнейшие
в производственном отношении продукты:
изопропилбензол
(кумол)
фенол ацетон
⎯ →⎯⎯
[О] H SO (разб.)
ООН
ОН
⎯ → +
О
4
Схема получения из кумола фенола приведена для ознакомления и не тре-
бует запоминания.
Ранее фенол выделяли только из каменноугольной смолы, образующейся
как побочный продукт коксохимического производства. Каменноугольную смо-
лу обрабатывали щелочами, а, как вам известно, водные растворы щелочей
взаимодействуют c фенолом с образованием фенолятов. Затем феноляты об-
рабатывали минеральными кислотами и получали фенол. Схематически процесс
экстрагирования фенола из каменноугольной смолы можно представить так:
каменноугольная смола C H ONa C HNaOH HCl
H O2 H O2
6 5 6 5⎯ →⎯⎯⎯ ⎯ →⎯⎯ ОH
Фенол можно получить, используя в качестве исходного вещества бензол.
При хлорировании бензола сначала получают хлорбензол, затем хлорбензол под
действием водного раствора гидроксида натрия дает фенолят натрия, который в
реакции с минеральными кислотами превращается в фенол:
С Н Cl C H ONa C H OH6 5
2
6 5
2
6 5
C, 300 атм
NaOH/H O
HCl
H O
350 °
⎯ →⎯⎯⎯⎯⎯⎯ ⎯ →⎯⎯
Этот способ получения фенола в настоящее время практически не исполь-
зуется как технически устаревший и экономически нецелесообразный. Однако
знакомство с ним представляет интерес как пример генетической связи между
углеводородами, галогенпроизводными и гидроксилпроизводными (фенолами).
Применение
Фенол и продукты, получаемые на его основе, находят широкое применение
(рис. 55). Практически половина производимого фенола расходуется на синтез
фенолформальдегидных смол. Полимеры на основе этих смол применяются для
Получение и применение фенола
Народная
асвета
Правообладатель Народная асвета](https://image.slidesharecdn.com/2963-161015095802/85/296-3-11-_-2013-318-139-320.jpg)













![153
Этаналь получают аналогичным методом:
2C2H5OH 2H2OO2 ++ 2CH3
этанол этаналь
Cu, t
⎯ →⎯
Уксусный альдегид был выделен в лаборатории немецким химиком Ю. Либихом в
1835 г., а первый представитель класса альдегидов — муравьиный альдегид — был
получен в лаборатории также немецким химиком А. Гофманом в 1868 г.
Одним из современных промышленных методов получения низших альде-
гидов является окисление алкенов кислородом воздуха в присутствии хлоридов
палладия и меди. Этаналь в промышленности получают преимущественно этим
методом:
CH2 O2+ 2CH3
этен этаналь
2CH2
PdCl CuCl
H O
2
2
⎯ →⎯⎯⎯⎯⎯⎯
В современной промышленности широко используется такой способ получения альдеги-
дов, как каталитическое дегидрирование первичных насыщенных спиртов.
Так, например, при пропускании паров этанола при высокой температуре над поверх-
ностью медного катализатора происходит дегидрирование этанола и образование
этаналя:
CH2OHCH3 CH3 H2+
Cu, t
⎯ →⎯ C
O
H
↑
Этот способ получения альдегидов объясняет само название класса — спирт дегидри-
рованный (от лат. alcohol dehydrogenates).
Этаналь можно получить гидратацией ацетилена в условиях реакции Куче-
рова в присутствии солей двухвалентной ртути:
CH H2O [H2C COH]CH CH3+
ацетилен виниловый спирт ацетальдегид
H+
, Hg2+
⎯ →⎯
Получение и применение альдегидов
Народная
асвета
Правообладатель Народная асвета](https://image.slidesharecdn.com/2963-161015095802/85/296-3-11-_-2013-318-153-320.jpg)












![168 Альдегиды и карбоновые кислоты
Вопросы и задания
1. Чем объясняется способность насыщенных одноосновных карбоновых кислот
проявлять кислотные свойства?
2. В реакциях с веществами каких классов неорганических соединений прояв-
ляются кислотные свойства уксусной кислоты?
3. Укажите, какие типы реакций из приведенных характерны для насыщенных
одноосновных карбоновых кислот: реакции замещения, присоединения, восстановле-
ния, обмена, отщепления, гидратации.
4. В двух пронумерованных пробирках находятся растворы уксусной кислоты и
уксусного альдегида. Приведите наиболее простой способ, позволяющий распознать,
в какой пробирке находится каждое из веществ.
5. Укажите формулы веществ, в реакции с которыми вступают насыщенные од-
ноосновные карбоновые кислоты: СI2, AI, KОН, С2Н5ОН, Na2SO4, K2СO3, KСІ, KHSO3,
СН2 СН СН2ОН.
6. Составьте уравнения реакций, при помощи которых можно осуществить сле-
дующие превращения:
а) СН3ОН → НСНО → НСООН → НСООNa;
б) →⎯⎯ →⎯⎯⎯ →⎯
O2 Cl2[O]
PкpPdCl2 CuСl
C2H4 ... ... ... .
7. Определите объем (н. у.) газа, который выделится при взаимодействии этано-
вой кислоты массой 53,4 г со взятыми с избытком: а) магнием; б) гидрокарбонатом
натрия.
8. При нагревании смеси этанола и пропановой кислоты в присутствии серной
кислоты получили сложный эфир массой 348,84 г. Рассчитайте химическое количест-
во пропановой кислоты, вступившей в реакцию.
9. Рассчитайте массу хлорэтановой кислоты, полученной в реакции хлора объ-
емом (н. у.) 62,72 дм3
в присутствии красного фосфора с этановой кислотой, взятой
в избытке. Выход продукта реакции 0,85.
10. К водному раствору уксусной и муравьиной кислот массой 100 г добави-
ли гидроксид натрия массой 24 г, который полностью нейтрализовал кислоты.
В результате образовался раствор солей с массовой долей ацетата натрия 0,1984.
Рассчитайте химическое количество муравьиной кислоты в первоначальном
растворе.
Лабораторный опыт 5
Химические свойства карбоновых и минеральных кислот
1. Налейте в две пробирки растворы уксусной и хлороводородной кислот
объемом примерно 1—2 см3
и добавьте к ним несколько капель раствора метил-
оранжа или лакмуса. Отметьте, произошли ли изменения окраски индикатора.
Составьте уравнения электролитической диссоциации кислот.
Народная
асвета
Правообладатель Народная асвета](https://image.slidesharecdn.com/2963-161015095802/85/296-3-11-_-2013-318-168-320.jpg)

![170 Альдегиды и карбоновые кислоты
В промышленности метановую (муравьиную) кислоту получают специальным способом.
При взаимодействии оксида углерода(ІІ) с расплавом гидроксида натрия при повышен-
ном давлении образуется соль муравьиной кислоты, которую под действием сильной
минеральной кислоты переводят в муравьиную кислоту:
СО + NaOH → HCOONa
формиат
натрия
HCOONa + H2SО4 → НСООН + NaHSО4
Мировое производство муравьиной кислоты составляет около 250 тыс. т
в год.
3) Высшие карбоновые кислоты, такие как пальмитиновая, стеариновая,
получают в результате гидролиза жиров.
Лабораторные способы
Первичные спирты и альдегиды окисляют подкисленными растворами пер-
манганата или дихромата калия и др.:
R CH2OH
[О]
⎯ →⎯⎯ R СООН
R СНО
[О]
⎯ →⎯⎯ R СООН
Применение
Широкое применение в народном хозяйстве находят метановая и этановая
кислоты.
Метановая (муравьиная) кислота обладает дезинфицирующими свойст-
вами, поэтому применяется в кожевенной и фармацевтической промышленнос-
ти, а также как консервант пищевых продуктов и кормов для скота. Ее исполь-
зуют для синтеза некоторых лекарственных средств, сложных эфиров и других
органических веществ, при крашении тканей и бумаги. На свойстве муравьиной
кислоты легко окисляться основано ее применение в технике в качестве вос-
становителя.
Наиболее широкое применение из всех карбоновых кислот имеет этановая
(уксусная) кислота (рис. 68). Большая часть производимой уксусной кислоты
используется в химической промышленности при производстве искусственных
волокон, в частности ацетатного волокна, а также в производстве красителей
(например, индиго), лекарственных соединений (например, аспирина), душис-
тых веществ. Уксусная кислота и ее производные сложные эфиры являются
хорошими растворителями многих органических веществ, поэтому применяются
при крашении в кожевенном производстве, в лакокрасочной промышленности.
Уксусная кислота как консервант широко используется в пищевой промыш-
ленности.
Народная
асвета
Правообладатель Народная асвета](https://image.slidesharecdn.com/2963-161015095802/85/296-3-11-_-2013-318-170-320.jpg)






















































![230 Углеводы
Глюкозу, полученную из остатков древесины в результате спиртового бро-
жения, перерабатывают в этиловый спирт и используют в смеси с бензином в
качестве биотоплива. Полученный этиловый спирт называют гидролизным и
используют также в качестве технического спирта, потому что он может содер-
жать небольшое количество токсичного метилового спирта.
2) Образование сложных эфиров
Для целлюлозы, благодаря наличию гидроксильных групп, характерна
реакция этерификации с образованием сложных эфиров. Для получения три-
ацетилцеллюлозы целлюлозу обрабатывают ангидридом уксусной кислоты
СН3СООСОСН3 в присутствии серной кислоты при нагревании:
H2SO4, t
...
...
......
Этерификация целлюлозы уксусным ангидридом приводит к тому, что три-
ацетилцеллюлоза оказывается способной растворяться в органических раство-
рителях.
При использовании в качестве ацилирующего агента уксусной кислоты из
целлюлозы образуется смесь моно- и диацетилцеллюлозы.
При частичном омылении триацетилцеллюлозы получают ацетилцеллюлозу,
раствор которой в ацетоне применяют для формования нитей ацетатного волокна.
Ацетатное волокно относится к химическим искусственным волокнам (см. рис. 77).
Сложные эфиры образуются также при обработке целлюлозы азотной кис-
лотой в присутствии серной кислоты:
[C6H7O2(OH)3]n + 3nHNO3
H SO2 4
→⎯⎯⎯⎯ [C6H7O2(ONO2)3]n + 3nH2O
Народная
асвета
Правообладатель Народная асвета](https://image.slidesharecdn.com/2963-161015095802/85/296-3-11-_-2013-318-230-320.jpg)
















![248 Амины. Аминокислоты. Белки
Химические свойства α-аминокислот
Химические свойства α-аминокислот определяются функциональными груп-
пами противоположного характера: карбоксильной группой с кислотными свойст-
вами и аминогруппой с основными свойствами. Аминокислоты реагируют как с
основаниями, так и с кислотами, проявляя при этом амфотерные свойства.
Рассмотрим химические свойства α-аминокислот на примере глицина.
1) Реакция по карбоксильной группе
Как кислоты аминокислоты реагируют с основаниями с образованием солей:
Для аминокислот, аминогруппа которых защищена солеобразованием, ре-
акции по карбоксильной группе протекают аналогично превращениям карбоно-
вых кислот. Аминокислоты легко образуют соли, сложные эфиры.
Реакция аминокислот со спиртами в присутствии сухого хлороводорода (HCl) приводит
к образованию сложных эфиров аминокислот в виде соли по аминогруппе:
2) Реакции аминогруппы
Реакции аминогруппы аминокислот аналогичны превращениям аминов. Как
амины аминокислоты взаимодействуют с сильными минеральными кислотами,
присоединяя протон:
+ +− −
H N CH COOH + HCl Cl [NH CH COOH]22 23
3) Специфические свойства
Важнейшее свойство аминокислот — их способность взаимодействовать
друг с другом. При определенных условиях карбоксильная группа одной моле-
кулы аминокислоты может реагировать с аминогруппой другой молекулы. При
этом отщепляется молекула воды и образуется соединение, в котором остат-
ки аминокислот связаны так называемой пептидной связью СО NH .
Продукт реакции называют дипептидом. Например:
Народная
асвета
Правообладатель Народная асвета](https://image.slidesharecdn.com/2963-161015095802/85/296-3-11-_-2013-318-248-320.jpg)




























![280 Обобщение и систематизация знаний по органической химии
б) H3C CH3
Cr O ,2 3 t
⎯ →⎯⎯⎯⎯ H2C CH2 + H2;
в) nCH2 CHCl⎯ →⎯ СН2 СНCl
3. Укажите, на основании каких признаков реакции хлорирования метана:
CH4 + Cl2
hν
⎯ →⎯⎯ CH3Cl + HCl
и этилена:
CH2 CH2 + Cl2
⎯ →⎯ CH2Cl CH2Cl
относят к разным типам.
4. На бромирование этена израсходован раствор брома в хлороформе массой
100 г с массовой долей брома 6,4 %. Определите массу продукта реакции.
5. При хлорировании и облучении светом метана химическим количеством
3 моль получены моно- и дихлорпроизводные метана в количественном отношении
2 1. Определите массу образовавшегося хлорметана.
6. Неизвестный алкен массой 7,0 г присоединяет бромоводород объемом (н. у.)
2,24 дм3
. Определите молярную массу и строение этого углеводорода, если известно,
что он является транс-изомером.
7. Приведите формулы продуктов в схемах реакций:
а) CH CH CH
Pt, HNO /H SO [H]3 2 4
3 2 4 3— —( ) ... ... ...
t
⎯ →⎯⎯⎯ ⎯ →⎯⎯⎯⎯⎯⎯⎯ ⎯ →⎯⎯ ;
б)
HNO /H SO3 2 4⎯ →⎯⎯⎯⎯⎯⎯⎯ ⎯⎯⎯⎯⎯⎯→Sn/HCl
иизбыток
NaOH⎯ →⎯⎯⎯ ⎯⎯⎯⎯⎯⎯→2 2Br /H O
избыток... ... ... ....
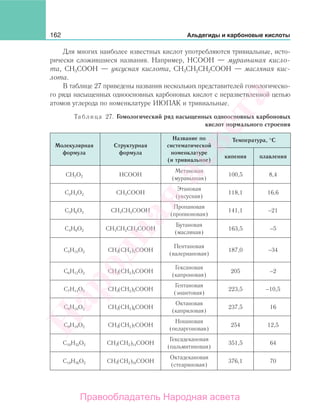
§ 60. Взаимосвязь между органическими соединениями
различных классов
Изучив курс органической химии, вы познакомились со строением, хими-
ческими свойствами и способами получения веществ различных классов орга-
нических соединений, относящихся к углеводородам и кислород- и азотсодер-
жащим функциональным производным углеводородов. При этом вы узнали, что
органические соединения различных классов связаны между собой взаимными
переходами. Знания о взаимных превращениях органических соединений необ-
ходимы для поиска рациональных и экономически выгодных путей получения
заданных и новых веществ.
Рассмотрим последовательно схемы взаимных превращений углеводородов,
кислородсодержащих и азотсодержащих соединений.
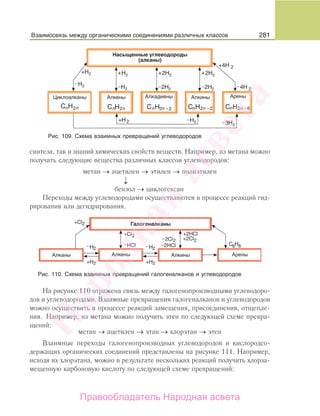
На рисунке 109 представлена схема взаимных превращений углеводородов.
Анализ схемы показывает, что реальны самые разнообразные переходы одних
углеводородов в другие. Пути получения продукта могут состоять из разного
числа химических реакций в зависимости как от исходного вещества, взятого для
Народная
асвета
Правообладатель Народная асвета](https://image.slidesharecdn.com/2963-161015095802/85/296-3-11-_-2013-318-280-320.jpg)

![283
исходя из конечного продукта. Последняя стадия получения аминоуксусной кис-
лоты осуществляется взаимодействием аммиака с монохлоруксусной кислотой.
В свою очередь, монохлоруксусная кислота получается хлорированием уксусной
кислоты. Следовательно, главная проблема заключается в поиске путей синтеза
уксусной кислоты. Ее можно получить из этена несколькими способами:
⎯→⎯⎯ ⎯ →⎯⎯⎯⎯
HCl
⎯→⎯⎯
[O]
⎯→⎯⎯
[O]KOH/H2O
CH3CH2Cl CH3CH2OH CH3CHO CH3COOHCH2 CH2
⎯→⎯⎯
[O]
PdCl2
O2
CH3CHO CH3COOH⎯→⎯⎯CH2 CH2
Анализ приведенных схем позволяет выбрать более рациональный путь по-
лучения указанной кислоты, который требует меньшего числа стадий, времени
и расхода реактивов. Запишем процесс получения аминоуксусной кислоты из
этена в виде одной схемы:
⎯→⎯⎯⎯→⎯⎯
[O] NH3
CH3CHO CH2NH2COOHCH3COOH CH2ClCOOHCH2 CH2
PdCl2
O2⎯→⎯⎯
P
Cl2⎯→⎯⎯
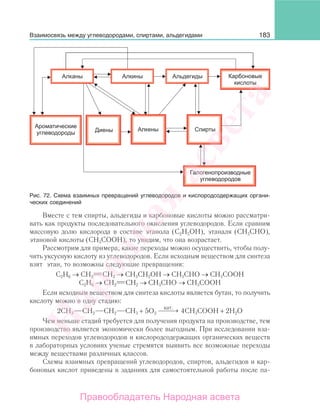
Разнообразные примеры переходов органических веществ служат доказа-
тельством взаимной связи между различными классами органических соеди-
нений. Понимание этой взаимосвязи позволяет уяснить сущность процессов,
происходящих в природе, на производстве, в быту. На основе знаний о взаимо-
связи между различными классами органических соединений ученые синтезиру-
ют тысячи разнообразных веществ, не только существующих в природе, но и не
существующих, а также веществ с заранее заданными свойствами.
Фундаментальной основой для получения органических веществ являются
углеводороды. Природными источниками углеводородов служат нефть и фрак-
ции ее переработки. Используются также природный газ и попутные нефтяные
газы, продукты коксования угля.
Рис. 112. Схема взаимных превращений кислородсодержащих и азотсодержащих орга-
нических соединений
Взаимосвязь между органическими соединениями различных классов
Народная
асвета
Правообладатель Народная асвета](https://image.slidesharecdn.com/2963-161015095802/85/296-3-11-_-2013-318-283-320.jpg)
![284 Обобщение и систематизация знаний по органической химии
Органические вещества связаны друг с другом взаимными перехо-
дами.
Фундаментальной основой органических веществ являются углеводо-
роды.
Знание химических свойств веществ и их взаимных превращений по-
зволяет выбирать рациональные пути получения заданных органических
веществ и синтеза новых веществ.
Вопросы и задания
1. Перечислите известные вам классы углеводородов, кислородсодержащих и
азотсодержащих органических соединений.
2. Укажите названия классов органических соединений, которые следует впи-
сать вместо пропусков в следующие схемы превращений:
а) алкан → ... → алкен → ... → галогеналкан;
б) алкен → насыщенный одноатомный спирт → ...→ ... → натриевая соль насы-
щенной одноосновной карбоновой кислоты.
3. Составьте схемы превращений органических соединений, исходя из предло-
женных, записав вместо названий формулы указанных в схемах веществ:
а) этен → этанол → этаналь → этановая кислота → хлоруксусная кислота →
2-аминоэтановая кислота;
б) бутен-1 → бутан → уксусная кислота → пропилэтаноат → ацетат магния;
в) пропанол-1 → пропаналь → пропановая кислота → этилпропаноат → этанол →
→ бромэтан.
4. Впишите в предложенные схемы превращений формулы органических ве-
ществ Х1 — Х6 и назовите их:
C2H2
a) X1 X2 X3 X4 X5;
H2O/H
+
, Hg
2+
Cu(OH)2
⎯ →⎯⎯⎯⎯ ⎯ →⎯⎯⎯⎯
CH3NH2
⎯ →⎯⎯⎯⎯
H2SO4
H2SO4
⎯ →⎯⎯⎯⎯
NaOH
⎯ →⎯⎯⎯⎯
C2H5Сlб) X1 X2 X3 X4 X5;
KOH/H2O
t 140 °C PbCl2 CuCl
Ag2O/NH3 H2O
⎯ →⎯⎯⎯⎯ ⎯ →⎯⎯⎯⎯
O2
⎯ →⎯⎯⎯⎯
⎯ →⎯⎯⎯⎯
NH3
⎯ →⎯⎯⎯⎯
[O]
⎯→⎯⎯⎯⎯
спиртовое
брожениеH2SO4
(C6H10O5)n
в) X1 X2 X3 X4 X5 X6.
H2O
⎯→⎯⎯⎯ ⎯ →⎯⎯⎯⎯
СuO, t
⎯→⎯⎯⎯⎯
KOH (р-р)
⎯→⎯⎯⎯⎯
KOH (тв.), t
⎯ →⎯⎯⎯⎯
5. Запишите над стрелками формулы реагентов и условия осуществления реак-
ций согласно следующим схемам:
а) СН3ОН → СН3NН2 → СН3NН3Cl → СН3NН2 → СН3NН2 HOOCCH3 → СН3NН2;
б) С2Н5Br → С2Н5OН → СН3CНO → СН3COOH → СН3COONa;
в) С2Н2 → С6Н6 → С6Н5Cl → С6Н5OH → С6Н5ONa → С6Н5OH.
6. Составьте уравнения реакций, при помощи которых можно осуществить сле-
дующие превращения:
а) глюкоза → этанол → этен → 1,2-дихлорэтан → хлорэтен → полихлорвинил;
Народная
асвета
Правообладатель Народная асвета](https://image.slidesharecdn.com/2963-161015095802/85/296-3-11-_-2013-318-284-320.jpg)